RNAアプタマー創薬に広く展開可能 創薬プロセスを大幅短縮
人工知能技術を応用した基盤情報技術RaptGenを開発
誰もが必要な薬にアクセスできる健康長寿社会の実現に一歩前進
発表のポイント
これまでアプタマー創薬は試行錯誤的に行われてきたため多くの時間を要し、かつ低分子化合物創薬に比べて情報技術の活用は圧倒的に遅れていた
本研究グループはこのたびアプタマー創薬に広く応用可能な人工知能技術を用いた新しい基盤情報技術RaptGen開発に成功した
新技術を用いたプロセス短縮により、アプタマー創薬に要する期間の削減と普及や、これまで難しかった創薬ターゲットに対する薬の開発が加速されることが期待される
早稲田大学理工学術院総合研究所 嘱託の岩野夏樹(いわのなつき)と同理工学術院 教授の浜田道昭(はまだみちあき)および株式会社リボミック(所在:東京都港区、代表取締役社長:中村義一)らの研究グループは、現在の薬の主流である低分子化合物に替わる次世代の新薬として注目されている「RNAアプタマー」の創薬期間を短縮するために、このたび、人工知能技術を応用し、アプタマー創薬に広く適用可能な基盤情報技術RaptGenを開発しその有効性を確認しました。
本研究成果は、Springer Nature社発行のオンラインジャーナル『Nature Computational Science』(論文名:Generative aptamer discovery using RaptGen)にて、2022年6月3日(金)0:00(日本時間)にオンラインで掲載されました。
(1)これまでの研究で分かっていたこと
現在の医薬品開発においては、創薬成功率の低下、創薬プロセスの長期化と高コスト化、製薬企業の研究開発力の低下が大きな課題となっています。これは現在の主流である低分子化合物では薬を開発することが困難である膜タンパク質*1などの難しい創薬ターゲットが多数残存していることが一つの要因だと考えられます。
そのため、低分子化合物に替わる次世代の創薬モダリティ*2の研究が行われています。次世代の創薬モダリティとしては、大きく分類するとバイオ医薬品(抗体医薬品)と中分子医薬品の2種類が研究されています。本研究では、中分子医薬品のひとつであるRNAアプタマー(以下アプタマーと呼ぶ)*3に注目しています。
現在のアプタマーの基礎・探索研究は試行錯誤的に行われ実験者の経験や勘に大きく依存しています。特に配列候補の選択と詳細な結合実験の繰り返しや、アプタマー配列の短鎖化*4実験に多くの時間を要していました。また、低分子化合物創薬に比べてアプタマー創薬における情報技術の活用は圧倒的に遅れていました。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
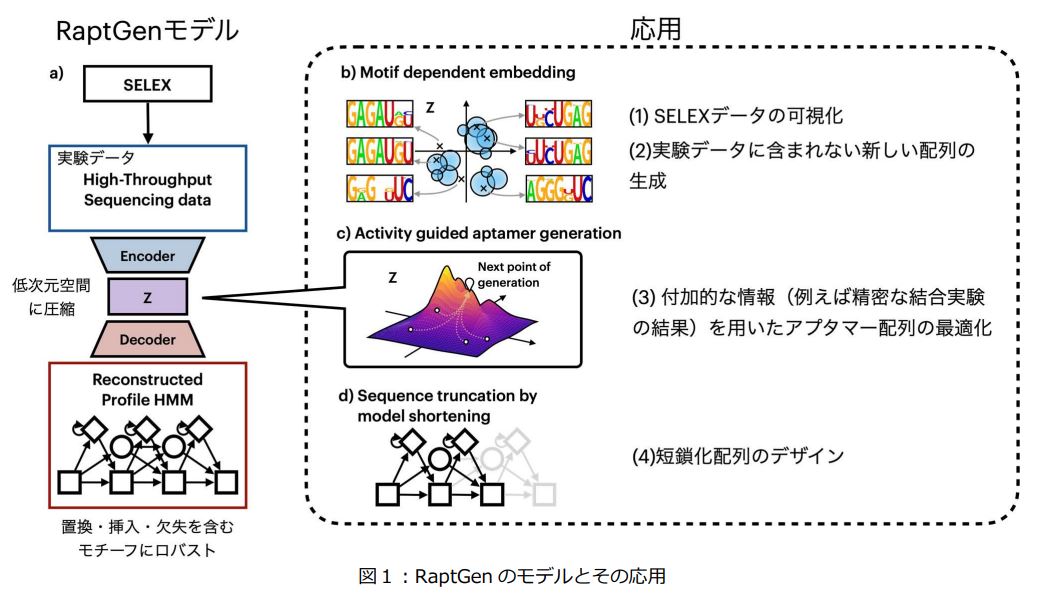
本研究グループは、アプタマー創薬研究の基盤として様々な応用が見込める新しいコンセプトの情報技術RaptGenを開発しました(図1)。
RaptGenでは、現在のアプタマー開発において標準的に用いられているSELEX*5から得られる配列データを活用しています。RaptGenにより、SELEXで得られた配列情報の可視化、SELEXデータに含まれない新しい配列の生成、付加的な情報を考慮したアプタマー配列の最適化、SELEXデータから短鎖化配列のデザインが可能となりました。
(3)そのために新しく開発した手法
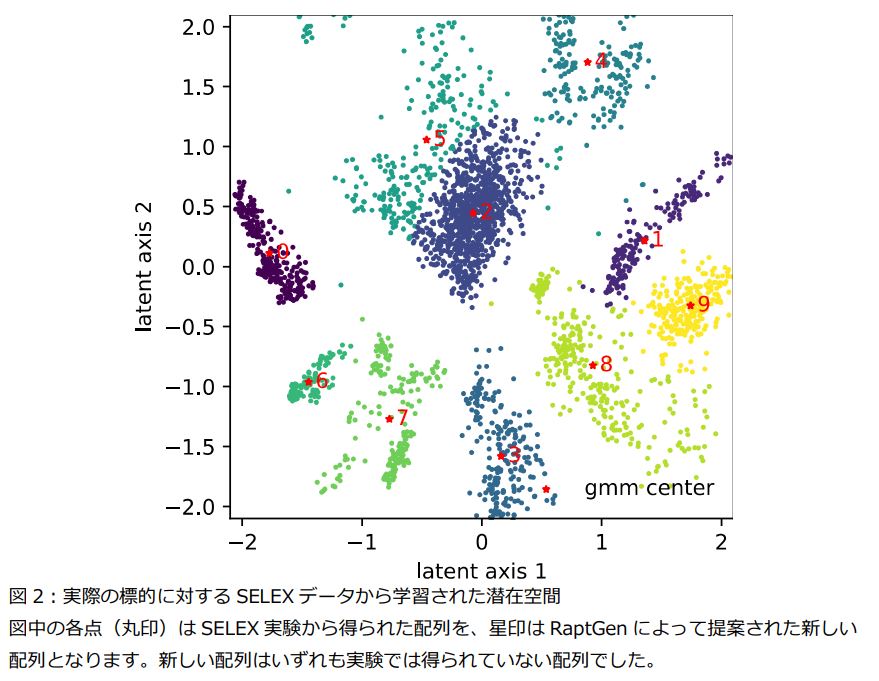
今回新たに開発したRaptGenは、SELEX実験から得られる大量の配列情報を人工知能分野で広く活用されている技術の一つである変分オートエンコーダー*6によりモデル化しています。この際には、アプタマーが標的に結合する際に重要となる局所的な配列モチーフ*7情報を適切に扱えるように、プロファイル隠れマルコフモデル*8と呼ばれる配列生成の確率モデルをデコーダー部分に用いました。さらに、RaptGenにより学習した低次元空間を活用することにより、(1) SELEXで得られた配列情報の可視化(図2)、(2) 潜在空間から新しい配列の生成、(3) 潜在空間上で付加的な情報を考慮したアプタマー配列の最適化、(4) 短鎖化配列のデザインが可能であることを示しました。
(4)研究の波及効果や社会的影響
RaptGenは、人工知能技術を用いることにより実験データに含まれない新しいアプタマー配列を生成することが可能となっています。これを短鎖化などに応用することにより、今まで経験的に行われ多くの時間を要していたプロセスが短縮され、アプタマー創薬期間の削減および普及に貢献することが見込まれています。また、今まで薬の標的とすることが難しかった膜タンパク質などの難しい創薬ターゲットに対する薬の開発が加速することも期待されます。
(5)今後の課題
現在のRaptGenはアプタマーが標的に結合する際に重要となるRNAの構造情報を考慮することはできません。さらに大規模なデータに適用するための計算コストの削減なども今後の課題になると考えています。これらの問題を解決するために引き続き研究に注力し、アプタマー創薬実験、バイオインフォマティクス、計算科学、人工知能技術などを融合した「AIアプタマー創薬」の確立を目指したいと考えています。
(6)研究者のコメント
アプタマーは次世代の新薬として今後その重要性が増していくことが予想されています。本研究で開発した情報技術RaptGenはアプタマー創薬を劇的に加速するキーテクノロジーになることを期待しています。これにより誰もが必要な薬にアクセスできる健康長寿社会の実現に少しでも貢献できればとても嬉しく思います。
(7)用語解説
※1 膜タンパク質
細胞の膜の中で働くタンパク質の総称。重要な創薬ターゲットだと考えられていますが現在の低分子化合物では薬を開発するのが難しいことが知られています。
※2 創薬モダリティ
創薬技術の種類、低分子化合物医薬品、中分子医薬品、抗体医薬品など様々な種類の研究が行われています。
※3 RNAアプタマー
次世代の創薬モダリティとして注目されている中分子医薬品の一つ。高親和性/高特異性を有する、低分子から膜タンパク質まで種々の標的分子に対して創製可能である、化学合成品で作製が容易、低い免疫原性を有するなど他の医薬品にない数多くのメリットを有しています。その一方で、2022年4月現在においてはRNAアプタマーで上市しているのは加齢黄斑変性症治療薬Macugen®(一般名pegaptanib)1例のみであり、他の核酸医薬であるアンチセンス(9例)、siRNA(4例)に比べると製品化が遅れています。
※4 短鎖化
アプタマーを実際に薬とするためには、得られたアプタマー配列候補の活性を維持したまま短くする必要があり、このプロセスを短鎖化と呼びます。この短鎖化プロセスでは、実験者が経験的に配列を短くしてその配列が活性を有しているかどうかの実験を行うことを繰り返し行う必要があり多くの時間が必要となっています。
※5 SELEX
ランダムな配列プールから標的に対する結合と増幅を何ラウンドも繰り返しながら高結合活性アプタマーの濃縮を行う実験技術。濃縮された配列プールを高速シークエンサーにより配列同定することにより、大量の配列候補が得られます。
※6 変分オートエンコーダー(VAE)
人工知能分野で広く活用されている技術の一つで、入力データを低次元空間(潜在空間)に圧縮(エンコード)し、潜在空間からもとのデータを復元(デコード)するモデル。学習した潜在空間から新しいデータを確率的に生成することが可能となります。
※7 配列モチーフ
アプタマーが標的に結合する際に重要となる短い特徴的な配列。モチーフは確定的な配列とはならずに、重要度が低い部分には塩基の置換・挿入・欠失などが入る可能性があります。
※8 プロファイル隠れマルコフモデル
挿入・欠失・置換を考慮した配列の確率的生成モデル。
(8)論文情報
雑誌名:Nature Computational Science
論文名:Generative aptamer discovery using RaptGen
執筆者名(所属機関名):岩野夏樹(早稲田大学)、安達健朗、青木一晃、中村義一(株式会社リボミック)、浜田道昭(早稲田大学、産業技術総合研究所、日本医科大学)
掲載日時(現地時間):2022年6月2日(木)16:00(BST)
掲載日時(日本時間):2022年6月3日(金)0:00(JST)
掲載URL:https://www.nature.com/articles/s43588-022-00249-6
DOI:10.1038/s43588-022-00249-6
(9)研究助成(外部資金による助成を受けた研究実施の場合)
研究費名:JST CREST「人工知能」(栄藤稔総括)
研究課題名:AIアプタマー創薬プロジェクト
研究代表者名(所属機関名):浜田 道昭(早稲田大学)