時計遺伝子を欠く変異体での概日減衰振動を発見

発表のポイント
- シアノバクテリアの概日時計は時計遺伝子3種類の1つの欠如でも弱い減衰振動を示すことを発見
- 時計遺伝子の1つを破壊したシアノバクテリアでも、24時間周期の外力を与える共鳴実験により、振れ幅の大きな概日周期性を持つことを解明
- 今まで認識されていなかった隠れたリズム現象が、今後哺乳類や高等植物でも見つかる可能性
早稲田大学理工学術院の岩崎秀雄(いわさきひでお)教授および河本尚大(かわもとなおひろ)助手、九州大学大学院芸術工学研究院の伊藤浩史(いとうひろし)准教授、立命館大学理工学部機械工学科の徳田功(とくだいさお)教授の研究グループは、シアノバクテリア※1の「概日時計※2(生物時計)」に関して、従来必須とされてきた3種類の時計遺伝子の1つがなくても、弱い振動(減衰振動)を生じることを発見しました。また、この時計遺伝子の1つを破壊したシアノバクテリアでも、24時間周期の外力を与える共鳴※3実験により、振れ幅の大きな概日周期性を持つことを明らかにしました。今後、今まで認識されていなかった隠れたリズム現象が、哺乳類や高等植物でも見つかる可能性があります。
本研究成果は、2020年5月7日午前10時(英国時間)に英国科学誌(オープンアクセス誌)『Nature Communications』のオンライン版で公開されました。
【論文情報】
雑誌名:Nature Communications
論文名:Damped circadian oscillation in the absence of KaiA in Synechococcus(KaiAを欠くSynechococcusの示す概日的な減衰振動)
DOI:10.1038/s41467-020-16087-x
(1)これまでの研究で分かっていたこと
概日時計研究で見過ごされがちだった減衰振動
睡眠覚醒を司る24時間周期の活動リズム(概日リズム)は、細胞に仕組まれた概日時計(体内時計、生物時計)によって駆動されます。この概日時計が生み出す概日リズムは非常に安定しており、温度や光を一定に保った条件下でも、約24時間周期の振動は数日ないし10日以上も維持されることがあります。このように振動が持続する性質のことを自律振動性と言い、概日リズムの重要な性質の一つと考えられています。この強い振動がどのように生み出されるのかについてはさまざまなモデル生物で研究が進んでおり、とりわけ先駆的な分子生物学的な研究は2017年度のノーベル生理学医学賞の対象にもなりました。一方で、こうした「持続性の高いリズム」に対して、すぐに減衰してしまうようなリズムも度々観察されてきましたが、解析のしにくさや表現型の地味さから敬遠される傾向がありました。しかし、減衰振動でも条件が整えば環境サイクルに適応するために有利でありうる可能性や、概日時計の進化の過程で減衰振動子から自律振動子に発展した可能性は十分にあります。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
従来リズムが消失すると考えられてきた時計遺伝子変異体での減衰振動の発見
概日時計は、ヒトだけでなく、植物、菌類、さらには光合成を行う原核生物のシアノバクテリアにも見られます。シアノバクテリアでは、光を一定に保った条件でも、ゲノム上のほとんどの遺伝子発現のオンオフが概日時計によって約1日周期で持続的に変動します。このリズムを生み出しているのは、KaiA、 KaiB、KaiCと名付けられた3種類の時計タンパク質です(注:以降、頭文字が大文字のものはタンパク質、頭文字が小文字で斜体になっているのは遺伝子や変異を意味します)。興味深いことに、これら3種類のタンパク質を試験管の中で混合すると、 KaiCタンパク質の示すリン酸化と呼ばれる酵素活性が 24時間周期で自律的に振動します。3つの時計タンパク質のどれか1つが欠けてもこのリズムは出なくなります。
シアノバクテリアの細胞内でも、それぞれの時計タンパク質を指定する遺伝子を破壊すると概日リズムが消失します。このような背景から、3つのKaiタンパク質は概日時計の根幹を担う必須の因子と考えられてきました。しかし今回の研究で、kaiA遺伝子が破壊された変異株でも、生物発光レポーター※4という技術を用いて詳しく観察すると24時間周期の減衰振動が観察されました(図1A)。kai遺伝子を破壊すると細胞のリズムが消失するのは常識とされており、従来の常識を覆す知見です。今回検証したリズムの振幅が非常に低いため、1998年のkai 遺伝子の発見以来20年以上も見過ごされてきたと考えられます。
この減衰振動は、残り2つの時計遺伝子kaiBとkaiCを破壊すると完全に消失しました。シアノバクテリアの多くはkaiA遺伝子を持ちますが、中にはkaiA遺伝子を進化の途上で消失してしまった系統が存在することが知られています。kaiAがなくてもkaiB、 kaiCを中心とする減衰振動が「弱い時計(タイマー)」として機能している可能性があります。

kaiA破壊株の減衰振動はれっきとした概日周期を持つ(外力による共鳴実験)
振り子やブランコに代表される減衰振動には、自身の固有周期に近いサイクルで外力(環境シグナル)を与えるとリズムの振れ幅(振幅)が増幅される性質があります。これを「共鳴」と呼びます。例えば、自力で漕ぐことが出来ない幼児のブランコは、適当なタイミングで背中を押してあげることで揺れ続けます。
同様にkaiA破壊株に様々な周期で弱い暗刺激を繰り返し与えたところ、24-26時間周期の外力を与えた場合に特に振幅の増加が見られました(図1B)。このことは、KaiAタンパク質を欠く減衰振動子は通常の概日時計と同じように約1日の明確な固有振動周期を持つことを示しています。また、このように「減衰振動子が周期外力によって共鳴し、強い振動を生み出せること」は、昼夜交代を伴う自然環境下では、減衰型の振動子であっても周期的な時計として細胞内の様々な活性を制御し、環境変化に適応できる可能性を示しています。
減衰振動を生じる分子メカニズム
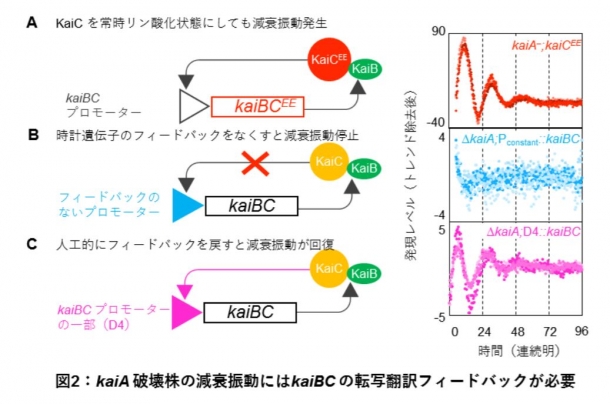
続いて、減衰振動発生のメカニズムを調べるために、kaiA破壊株中のkaiBCを初めとする時計関連遺伝子を変異させました。kaiBやkaiC遺伝子に変異を入れると、周期長が著しく変化する場合があります。その結果、kaiAを持つ野生株で大きく周期長を変化させる変異でも、kaiAを欠く減衰振動の周期には殆ど影響を与えないことが分かりました。特にKaiCのリン酸化修飾を受けるアミノ酸残基をグルタミン酸に置換したkaiCEE変異を導入すると、kaiAが存在する場合には48-60時間に長周期化しますが、kaiAを欠いた状態で導入しても減衰振動は約23時間周期で同様に観察されました(図2A)。このことは、減衰振動の発生に、周期的なKaiCのリン酸化振動が必要ではないことを意味します。
この減衰振動には、シアノバクテリアでは二次的なものと考えられていたkaiBC遺伝子の発現の切り替え(転写翻訳フィードバック※5)が必要と考えられます。この転写翻訳フィードバックとは、時計遺伝子の発現を、それによって指定される時計タンパク質が調節することで転写レベルの振動を生み出すという仕組みです。真核生物では主要な発振機構と考えられていますが、シアノバクテリアでは試験管の中で一定レベルのKaiタンパク質を混合するだけでリズムを駆動できるので、必須ではないことが分かっています。
そこで転写翻訳フィードバックがなくなった場合、減衰振動が残るのかどうかを検証しました。kaiBC遺伝子の発現を調節するプロモーター部位を、KaiCからの発現フィードバックを受けない種類に交換してみたところ、減衰振動は見られなくなりました(図2B)。このことは、KaiAを欠く条件下で見られる減衰振動には転写翻訳フィードバックが必要であることを強く示しています。
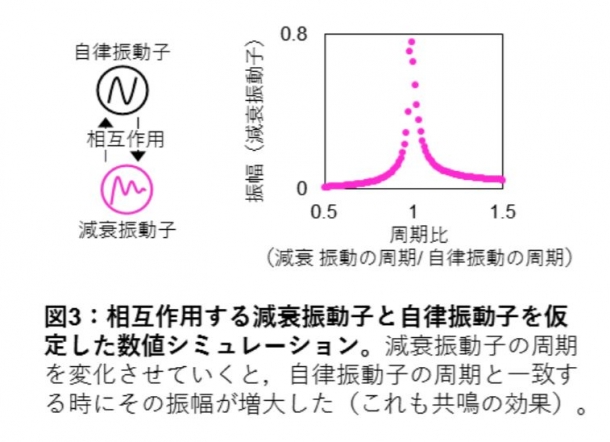
減衰振動が24時間周期である意義(2種の振動子の相互作用による共鳴)
本研究グループは、不完全な時計システムとしての減衰振動子が実際の細胞内でどのように役立っているかを調べるために、単純化した2つの関連する振動子(結合振動子)の数理モデルを用いてシミュレーションを行いました。この数理モデルは、KaiCのリン酸化振動を想定した自律振動子と、kaiA破壊株を想定した減衰振動子の2つの振動子から構成され、これらの性質の異なる2つの振動子が相互作用すると考えられます。振動子同士が相互作用すると、減衰振動子のリズムは自律振動子のリズムに引き込まれます。ここで減衰振動子の周期を変化させていくと、「減衰振動子と自律振動子の周期が離れるほど振幅が小さくなり、周期が近ければ近いほど振幅が増大する」という共鳴現象が見られました(図3)。この数理シミュレーションから、減衰振動性を持つ(KaiAに依存しない)転写翻訳フィードバックループが、細胞内でKaiCリン酸化振動と共鳴し、自身の振幅を効率的に最大化させる可能性が示されました。
(3)研究の波及効果や社会的影響
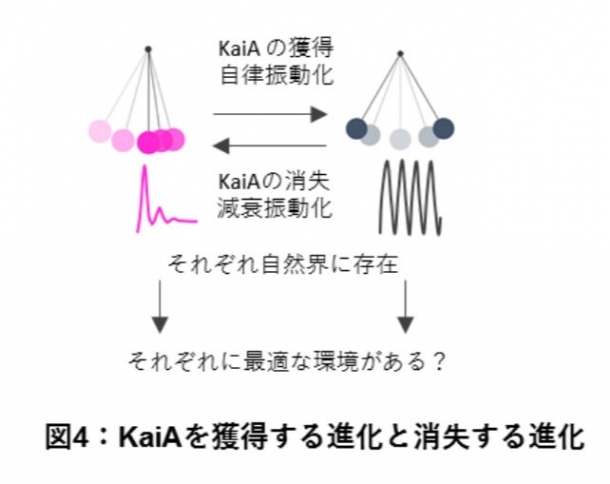
これまで概日時計の研究分野では、高い振幅を持つ持続的な概日リズムに研究が集中する傾向があり、すぐに減衰してしまう「弱い振動」はあまり注目されてきませんでした。しかし、概日時計の進化の過程では高い自律性を誇る持続的な概日時計が突然誕生したはずはなく、減衰型の振動システムが中間段階として存在したと考えられます。KaiAの獲得や消失は実際の進化において辿った道のりであると考えられ、自然環境中のシアノバクテリアにおいてもKaiAを持つものと持たないものがいます。そのため、KaiAを得て自律振動型の時計を得ること、KaiAを失い減衰型の計時機構になることそれぞれに適応的意義があるとも考えられます(図 4)。
今回の知見はこうした時計の進化について重要な示唆を与えるだけでなく、完成された持続的な概日時計であってもその背後に減衰振動が潜んでいる可能性を示しています。実際、概日リズムの発生に複数の制御ループがカップリングしていることは、従来様々な生物種で断片的に観察されてきました。それらの中には単独で弱い減衰振動を示すものも含まれている可能性があり、シアノバクテリアに限らず、概日時計システムに果たす減衰振動子の役割に関心が高まることが期待されます。
(4)今後の展開
哺乳類や高等植物の概日システムにおいても同様の知見が得られた場合、減衰振動や共鳴現象についての考え方を適用することで、より精度の高い生物リズムの操作・応用ができる可能性があります。
(5)用語解説
※1 シアノバクテリア
藍藻(らんそう)とも呼ばれる植物と同様に酸素発生型の光合成を行う原核生物(細菌、バクテリア)。今回の研究で用いたシネココッカス(Synechococcus)は単細胞性シアノバクテリアの一種で、概日時計研究によく用いられるモデル生物。
※2 概日時計
一定の環境条件でも自律的に約24時間周期の生物リズム(概日リズム)を駆動する内因性のメカニズムのことを概日時計(生物時計)と呼ぶ。概日時計を構成する遺伝子は時計遺伝子と呼ばれ、時計遺伝子の変異や欠損によって概日リズムは大きく変化する。シアノバクテリアのkai遺伝子群は、名古屋大学の近藤孝男教授・石浦正寛教授らの研究グループによって1998年に発見され、回転kaitenに因んで名づけられた。
※3 共鳴
減衰振動子に対し、特定の周期で刺激を与えると振動の振れ幅(振幅)が増す現象。最も振幅が増した際の周期を振動子の固有周期と呼ぶ。2017年に執筆者の伊藤浩史准教授と岩崎秀雄教授らの共同研究グループは、KaiA、KaiB、KaiCからなる試験管内概日リズム再構成系を用いて、KaiCのリン酸化リズムが低温下で減衰振動化し、周期的に弱い低温パルスを与えることで共鳴することを報告している。今回の研究はこの知見を生体内(kaiA破壊株)に適用した側面がある。
※4 生物発光レポーター
遺伝子の発現(DNAからRNAへの転写)の強さを、生物発光の強さに置き換えて測定する手法。特定の遺伝子の発現を調節するDNA配列(プロモーター領域)をとりだし、その下流に人工的に生物発光酵素を指定する遺伝子を融合させ、細胞に導入する。すると、解析したい遺伝子の発現強度に従って、生物発光酵素の合成量が変化する。概日リズムの場合、概日時計によって制御される遺伝子の発現の活性が、蛍のように点滅する光として観察できる。細胞を壊さずに、生きたままの状態で測定できるため実験誤差が少なく、また、非常に細かい時間分解能で正確に発光強度をモニターできるため、今回のような振幅の低いリズムの観察には不可欠である。
※5 転写翻訳フィードバック
タンパク質が自身を指定する遺伝子の発現に影響を与えることを指す。特に真核生物の概日リズムについては、時計タンパク質が自身を指定する時計遺伝子の発現を負に制御(抑制)する「負のフィードバック」によって基本振動が生み出されることが示されている。ショウジョウバエの時計遺伝子に関して、初めてこのモデルを実験的に証明した研究者たちが、2017年のノーベル生理学医学賞を受賞した。シアノバクテリアでも当初はこのモデルが採用され、今回の研究でも時計遺伝子kaiBCの遺伝子発現に見られるリズムを時計の指標として観察している。しかし、シアノバクテリアでは2004年に岩崎教授らが転写翻訳フィードバックを停止させてもKaiCのリン酸化リズムが持続することを示し、転写翻訳フィードバックがリズム発生に必須ではないことを明らかにしていた。
(6)論文情報
雑誌名:Nature Communications
論文名:Damped circadian oscillation in the absence of KaiA in Synechococcus(KaiAを欠くSynechococcusの示す概日的な減衰振動)
執筆者名(所属機関名):
- 河本尚大(早稲田大学先進理工学研究科後期博士課程 同学科助手)筆頭著者
- 伊藤浩史(九州大学大学院芸術工学研究院准教授)
- 徳田功(立命館大学理工学部機械工学科教授)
- 岩崎秀雄(早稲田大学理工学術院(先進理工学部電気・情報生命工学科)教授)責任著者
掲載日時(英国時間):2020年5月7日(木)午前10時
掲載日時(日本時間):2020年5月7日(木)午後6時
DOI:10.1038/s41467-020-16087-x







