神経細胞のアクチン細胞骨格を担う因子を発見
さまざまな疾患発症原因の解明に寄与することを期待
発表のポイント
- 大脳の神経細胞に発現するInka2が、Pak4のリン酸化を直接阻害することでアクチン細胞骨格の形成を調節することを発見した。
- Inka2によるPak4-LIMK-Cofilinシグナル経路の抑制が、正常な神経細胞のシナプス(樹状突起スパイン)形成に重要であることを明らかにした。
- このInka2によるスパイン形成機構が、さまざまな疾患発症原因の解明に寄与できると期待される。
概要
早稲田大学人間科学学術院の榊原 伸一(さかきばら しんいち)教授、山田 晴也(やまだ せいや)助教らの研究グループは、新規同定したInka2が脳の神経細胞のアクチン細胞骨格(アクチンフィラメント)の制御を介してシナプス(樹状突起スパイン)形成を調節する機構を明らかにしました。神経細胞の成熟と共に樹状突起上に形成されるスパインは、神経細胞同士が情報を適切にやり取りするシナプスの形成に必須です。Pakファミリー※1によるアクチンフィラメントのダイナミックな重合・脱重合は、スパインの適切な個数や形態を管理しています。我々が生きる上で重要な生命現象であるこの制御機構の破綻は、統合失調症や自閉スペクトラム症、アルツハイマー病など様々な精神疾患や発達障害に関与します。しかし、その制御機構には未解明な点が多くありました。
本研究グループは、Inka2とアクチンフィラメントの重合因子Pak4に着目し、Inka2が脳内の神経細胞特異的にPak4の酵素活性を阻害し、アクチンフィラメントの重合を抑制することを発見しました。そして、Inka2が脳内で欠損するとPak4-LIMK-Cofilinシグナル経路が亢進し、スパイン形成の異常を引き起こすことを明らかにしました(図1)。本研究で明らかにされたInka2によるスパイン形成機構が、様々な疾患発症原因の解明に寄与できると期待されます。
本研究成果は、米国のオープンアクセスジャーナル『PLOS Genetics』のオンライン版に2022年10月28日(火)AM 3:00(日本時間)に掲載されました。
 図1: Inka2によるアクチン細胞骨格制御を介した樹状突起スパイン形成機構
図1: Inka2によるアクチン細胞骨格制御を介した樹状突起スパイン形成機構
(1)これまでの研究で分かっていたこと
アクチン細胞骨格の重合・脱重合のバランスは、神経細胞の樹状突起スパインの形成・安定性に重要な役割を果たします。アクチンフィラメントを重合する制御機構として、セリン・スレオニンキナーゼ※2であるPakファミリー(Pak1-3のグループIとPak4–6のグループII)及びその下流シグナル因子であるLIMK、Cofilinが知られています。Pakファミリーの適切な制御は、異常なスパイン形成を防ぎ、健全な脳の発達を促進する上で非常に重要ですが、そのような内在性Pakの阻害因子は神経細胞では未だ見つかっていませんでした。一方、本研究グループがマウス脳内から新規同定したInka2遺伝子は、大脳皮質や海馬の神経細胞に豊富に存在します。また、Inka2タンパク質と相同性の高いInka1タンパク質は共にinka Box(iBox) 領域を持ち、iBoxとPak4が相互作用することが示唆されていました。しかしながら、Inka2の脳内における役割及びPak4との関係性は明らかになっていませんでした。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
本研究ではまず、「Inka2タンパク質のiBoxが、Pakファミリーのリン酸化能をブロックすることでアクチンフィラメントの重合を阻害する」という仮説を検証しました。培養細胞にInka2の過剰発現またはPak4の発現抑制を行うと、細胞内のアクチンフィラメントが脱重合し、細胞の輪郭が球形になりました。Inka2がアクチンフィラメント及びPak4と共局在しアクチン骨格形成に関与することから、Inka2のiBox領域がPak4と相互作用することを、Inka2のiBox欠失体(Inka2-ΔiBox)を用いて検証しました。免疫沈降実験からInka2-iBox依存的にPak4と相互作用することが明らかになりました。また、Inka2-ΔiBoxの過剰発現でアクチンフィラメントの脱重合は起こりませんでした。Inka2のiBox領域が直接的にPak4のリン酸化能を阻害するのかを検証するため、大腸菌由来の精製タンパク質を用いた、無細胞系のin vitroリン酸化アッセイを行いました。Pak4、Inka2-iBox、Inka1-iBox、そしてPak4のリン酸化に必要な基質を反応させると、Inka1-iBoxとInka2-iBoxで共に、濃度依存的にPak4の酵素活性を強く抑制することが明らかになりました(図2)。その一方で、グループIのPakファミリーへの抑制効果は見られませんでした。以上より、Inka1とInka2が持つiBoxは、グループIIのPakファミリー(特にPak4)のリン酸化能を直接的に阻害することでアクチンフィラメントの脱重合に関与することが明らかになりました。
 図2:Inka1とInka2によるPak4の酵素活性の抑制
図2:Inka1とInka2によるPak4の酵素活性の抑制
次に、「Inka1とInka2が、脳内でPak4を負に制御することで神経細胞のアクチン細胞骨格形成を制御する」という仮説を検証しました。我々はまず、Inka2のコンディショナルノックアウトマウスを作製し、Inka2の脳内における空間的な発現局在をLac Z染色※3とIn situ hybridizationを用いて調べました。Inka2 mRNAは前脳背側の大脳皮質や海馬などの神経細胞特異的に豊富に存在していました(図3)。
 図3:マウス背側前脳におけるInka2 mRNAの特異的な発現局在(青色)
図3:マウス背側前脳におけるInka2 mRNAの特異的な発現局在(青色)
その一方で、Inka1は脳内での発現は見られませんでした。Inka2の脳内における生理機能を明らかにするため、全身性のInka2ノックアウトマウス(Inka2-/-)を樹立しました。Inka2-/-マウスは正常に成体へと成長し、脳における解剖学的な変化は見られませんでした。そこで、神経細胞の詳細な形態変化をGolgi染色※4により検証しました。生後1ヶ月齢以降のInka2-/-マウスでは、大脳皮質の錐体神経細胞の樹状突起の異常な屈曲及び変化樹状突起スパイン形成の不全が起きることが明らかになりました(図4)。また、Inka2-/-マウスのスパイン形成不全は、Inka2-/-マウス由来の初代培養神経細胞でも同様に見られました。それ故、この表現系は神経細胞の内在的な影響であり、神経細胞の成熟過程で起きることが明らかになりました。
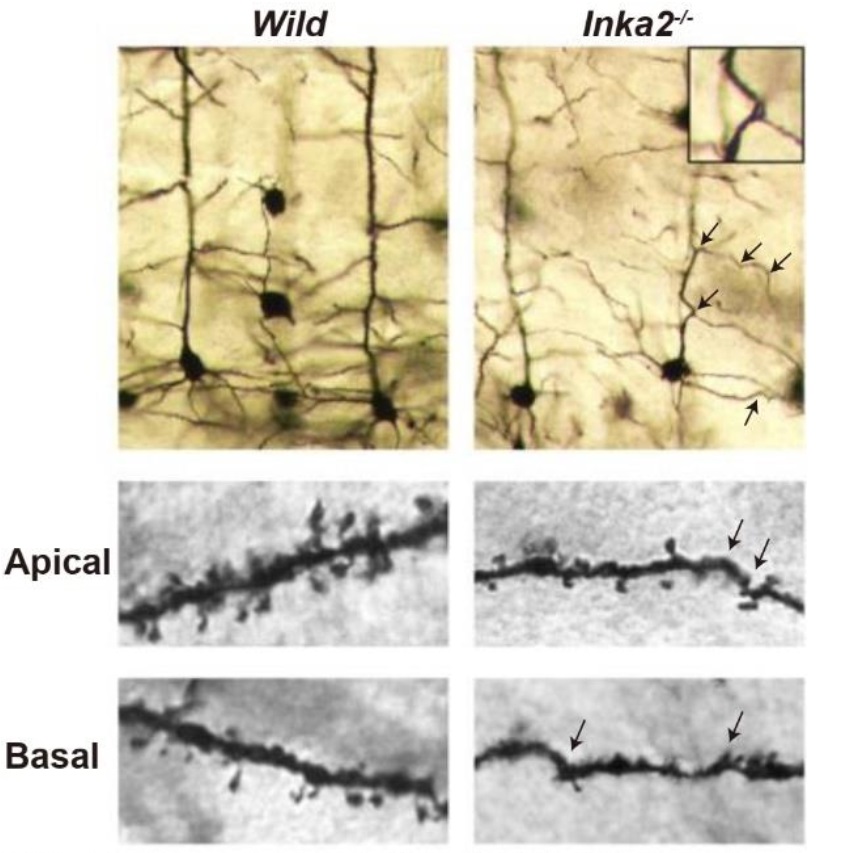 図4:Inka2-/-マウスの大脳皮質の錐体神経細胞の樹状突起の形態異常(矢印)とスパインの形成不全(2・3段目)
図4:Inka2-/-マウスの大脳皮質の錐体神経細胞の樹状突起の形態異常(矢印)とスパインの形成不全(2・3段目)
最後にInka2の欠損がPak4シグナルに影響を与えるかを大脳皮質の神経細胞のシナプスから単離したシナプトニューロソーム(SN)※5を用いて検証しました。Inka2-/-群のSNではPak4の下流シグナルでアクチンフィラメントの重合を制御する経路であるLIMK、Cofilinのリン酸化が亢進することが明らかになりました(図5)。即ち、Inka2の欠損により、Pak4の酵素活性が過剰亢進し、その結果としてPak4-LIMK-Cofilinシグナルのリン酸化も亢進することで、スパイン形成の異常が起きることが明らかになりました(図6)。

(3)研究の波及効果や社会的影響
Pakファミリーによるスパイン形成制御は、統合失調症や自閉スペクトラム症、アルツハイマー病など様々な精神疾患や発達障害に関与します。また、Pakファミリーは神経系以外においてもがんを始めとした様々な疾患に関与することが分かってきています。本研究でInka2が、脳内における初めてのPak4阻害因子であることが明らかになりました。今後Inka2が関与する疾患発症の原因解明やInka2によるPak4阻害をターゲットとする創薬開発へつながることが期待されます。
(4)今後の課題
今回、脳内におけるInka2の役割が明らかになりましたが、他の組織においてのInka1とInka2の各々の役割は未だ不明です。また、Inka2がPak4以外のグループIIのPakファミリーにおいても同様の阻害効果を持つかについても不明な点を多く残しています。これらの謎を明らかにしていくことが、今後の研究課題になると考えられます。
(5)研究者からのコメント
本研究は早稲田大学の研究グループ(山田 晴也助教, 水越 智也氏)と福井大学の徳永 暁憲准教授、皆様の協力により論文化できました。細胞内のアクチン細胞骨格は、神経細胞のスパイン形成をコントロールすることで多数の精神疾患にも関与する重要な生命現象です。本研究は、神経細胞のアクチン細胞骨格の新たな調節機構を発見したこと、また脳内でPak4活性を阻害する働きを持つ新たな因子を発見したことから、今後は基礎研究のみならず、臨床的な観点からも社会的な意義は大きいと考えています。
(6)用語説明
※1 Pakファミリー
Pak4ファミリーは構造的・生化学特徴からPak1–3のグループIとPak4–6のグループIIに分けられる。Rho GTPaseに関与するプロテインキナーゼの1つであり、RacやCdc42の下流因子、LIMK-Cofilinシグナル経路の上流因子としてアクチンフィラメントの重合を制御する。
※2 セリン・スレオニンキナーゼ
ATPからリン酸基を、基質タンパク質のセリン・スレオニン残基へ共有結合させる酵素であり、プロテインキナーゼの1種。ホスファターゼと共役することで、リン酸化・脱リン酸化のバランスが制御され、細胞骨格形成や細胞接着などの多様な生理現象に重要な役割を担う。
※3 LacZ染色
目的遺伝子の発現を判別するために使用されるレポーター遺伝子LacZの染色法。細胞内でLacZを発現すると、その翻訳物であるβガラクトシターゼがX-gal 基質の加水分解を触媒し、LacZ発現細胞は青色に発色する。本研究で用いたInka2コンディショナルノックアウトマウスには、Inka2の遺伝子発現を確認するためにLacZが挿入されており、Inka2の遺伝子発現が青色に可視化できる。
※4 Golgi染色
神経細胞の形態を可視化するための鍍銀染色法の⼀種。脳内の細胞がランダムに、そして疎らに黒く染色されるため、微細構造の観察が組織レベルで可能となる。
※5 シナプトニューロソーム(SN)
脳内の神経細胞が持つポストシナプスとプレシナプスを特異的に分画したもの。シナプトニューロソームの分画により、シナプスに関与する因子群(PSD95など)のみを得ることができ、それらの局所的な発現量などを調べることができる。
(7)論文情報
雑誌名:PLOS Genetics
論文名:Inka2, a novel Pak4 inhibitor, regulates actin dynamics in neuronal development
執筆者名(所属機関名): 山田 晴也1, 水越 智也1, 徳永 暁憲2, 榊原 伸一1*
1)早稲田大学 人間科学学術院 分子神経科学研究室
2)福井大学 ライフサイエンス支援センター生物資源部門
*)責任著者
掲載日時(現地時間):10月27日(木)11:00(太平洋時間)/14:00(米東部時間)
掲載日時(日本時間):10月28日(金)3:00
掲載URL:https://journals.plos.org/plosgenetics/article?id=10.1371/journal.pgen.1010438
DOI:https://doi.org/10.1371/journal.pgen.1010438
(8)研究助成
研究費名:基盤研究(C)
研究課題名:神経前駆細胞の形態・移動を制御する新規分子群の機能解明
研究代表者名(所属機関名):榊原 伸一(早稲田大学)
研究費名:基盤研究(C)
研究課題名:樹状突起スパインの形成・安定性を担う新たなアクチン骨格制御機構の解明
研究代表者名(所属機関名):榊原 伸一(早稲田大学)