耐熱性と常温で十分な酵素活性を併せ持つ酵素を創出 多くの工業プロセスにおいて低エネルギーコスト、環境負荷の低減に期待
発表のポイント
- 情報科学と実験科学の融合により、過去には存在したが現在は消失した酵素を復元した
- 最も古い祖先よりも現代に近い年代の酵素を復元したところ、高い耐熱性と常温での高い酵素活性を併せ持つ、現存の天然酵素にはあまり見られない特性を示した
- この手法を用いることで、従来の酵素設計法である合理的設計や進化分子工学と比べて少ない実験量で、常温で十分な酵素活性を持ち、且つ、耐久性のある酵素の開発が期待できる
- この手法を様々な酵素に適用することによって、多くの工業プロセスにおいて酵素利用を推進できると期待され、低エネルギーコスト、環境負荷の低減に貢献できる
早稲田大学人間科学学術院の赤沼哲史(あかぬま さとし)教授、古川龍太郎(ふるかわ りゅうたろう)助教らの研究チームは、現在の自然界には存在しないが過去には存在したと推定される酵素の祖先アミノ酸配列を予測し、実際に復元しました。得られた祖先復元型酵素の耐熱性と酵素活性を調べた結果、常温での高い酵素活性と耐熱性を併せ持つ、現存の天然酵素にはあまり見られない特性を持つ酵素であることが分かりました。耐熱性酵素は高温で安定しているだけでなく、界面活性剤や酸・アルカリ、有機溶媒にも耐性を示すことが多く、常温でも非耐熱性酵素に比べて半減期(注1)が長いことが知られていますが、多くの場合、常温ではほとんど酵素活性を示しません。したがって、本研究の手法を様々な酵素に適用することで、食品や飲料の製造等、常温での酵素反応を必要とする多くの工業プロセスに利用可能な耐久性のある酵素の開発が期待されます。
【論文情報】
・掲載誌:Scientific Reports
・論文名:Ancestral sequence reconstruction produces thermally stable enzymes with mesophilic enzyme‑like catalytic properties
・掲載日時:2020年9月23日(イギリス・現地時間 午前10:00)
・DOI:10.1038/s41598-020-72418-4
1.これまでの研究で分かっていたこと(研究の背景)
酵素は、生物がもつ天然のタンパク質性触媒であり、高い触媒効率を示すにも関わらずエネルギーコストや環境への影響が小さく、私たちが日常的に目にする洗剤、飲食料品や医薬品などの合成、環境浄化など様々な用途で既に利用されています。しかし、生体分子である酵素は、その性質が宿主生物の生息環境に適応しているため、必ずしも常にそのまま細胞外で人間社会に役立てられるとは限りません。特に、天然の酵素は細胞内では不要となった際にすぐに不活性化される必要があるため、壊れやすい性質を持ちますが、この耐久性の小ささがしばしば酵素利用の妨げとなっています。一方、高温環境に生息する微生物である好熱菌(注2)は、耐熱性に優れた酵素を持つことが知られています。しかし、多くの好熱菌酵素は常温における酵素活性が著しく小さいため、飲料や食料品加工など、高温にできない工業プロセスでの利用が困難です。それでも好熱菌酵素のような耐熱性酵素は、高温だけでなく、界面活性剤や酸・アルカリ、有機溶媒存在下でも安定であり、常温でも非耐熱性酵素に比べて半減期が長い場合が多いことも知られています。したがって、常温でも十分に機能する耐熱性酵素の開発は、酵素利用を推進するための重要な課題となっています。
耐熱性や活性の改善など、従来の酵素の改変は主に「合理的設計」、または、「進化分子工学」によっておこなわれてきました。合理的設計は、酵素の詳細な立体構造をもとに、タンパク質化学の知識を総動員して酵素の性質を変える手法ですが、現時点では、酵素が高温や低温に物理的に適応する仕組みについて包括的な理解が得られているわけではないため、必ずしも常に思ったように酵素を改変できるわけではありません。進化分子工学は酵素の立体構造やタンパク質化学の知識を必要としないで、目的の性質を持った酵素の改変体を選択する手法ですが、目的とする特性を選択するためには、多様化した遺伝子集団(ライブラリー)を構築し、徹底的に調査する必要があり、多くの場合、多大な時間と労力を必要とします。
私たちの研究グループでは、情報科学に基づく分子系統解析(注3)と実験科学の手法である遺伝子工学・タンパク質工学の技術を融合することによって、過去に存在したが現在は既に消失したと想定されるタンパク質(酵素)の祖先アミノ酸配列を推定し、復元する祖先配列再構成(図1)を実施してきました。これまでの私たちの研究では、主に進化系統樹(注4)の最も根元の位置(38億年前ごろに生息した全生物の最後の共通祖先(注5))のアミノ酸配列を推定・復元してきました。こうして得られた祖先復元型タンパク質は高い耐熱性を有したことから、全生物の最後の共通祖先は好熱菌または超好熱菌であった可能性を指摘しました。さらに、祖先配列再構成によって作られた酵素の中には、現存の超好熱菌酵素よりも高い耐熱性を持つものがあり、祖先配列再構成が超耐熱性酵素の有効な設計方法であることも提案してきました。
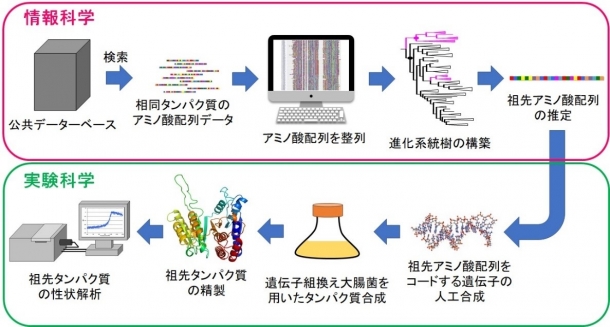
図1.情報科学と実験科学を融合させた祖先配列再構成の概略
2.今回の研究で明らかにしようとしたこと
これまでの研究では、全生物の最後の共通祖先に相当する祖先アミノ酸配列を推定・復元し、その耐熱性を調べてきましたが、常温での触媒活性には着目してきませんでした。今回の研究では、より高い耐熱性を求めるのではなく、ある程度の耐熱性を持ちつつ常温で活性のある酵素を得ることを目的としました。そこで、全生物の最後の共通祖先ではなく、それよりも現代に近い、真正細菌(注6)が持つイソプロピルリンゴ酸脱水素酵素(IPMDH、注7)の共通祖先配列を推定・復元し(図2)、耐熱性と様々な温度における酵素活性を解析することによって、復元した酵素がどのような性質を持つか調べました。
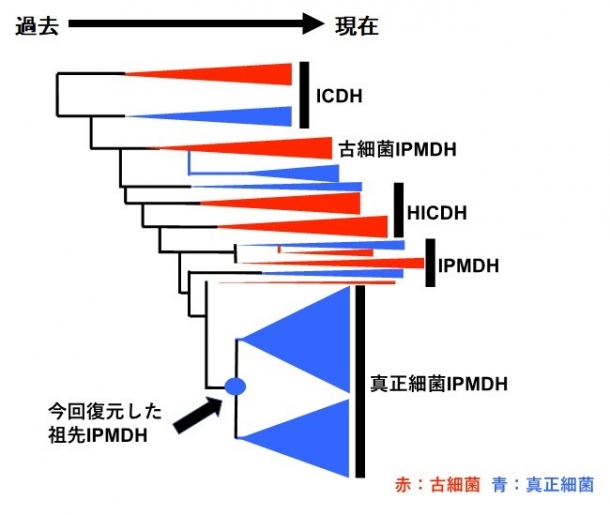
図2.イソプロピルリンゴ酸脱水素酵素(IPMDH)とその類縁酵素(ICDH:イソクエン酸脱水素酵素、HICDH:ホモイソクエン酸脱水素酵素)のアミノ酸配列から推定された進化系統樹。真正細菌由来IPMDHの共通祖先の位置を矢印で表示した。真正細菌の配列を青、古細菌の配列を赤で示した。
3.今回の研究で得られた結果及び知見
異なる祖先配列推定アルゴリズムを用いて推定・復元した2つの真正細菌IPMDHの共通祖先酵素(ancIPMDH-IQとancIPMDH-ML)は、どちらも至適生育温度が27~37℃の枯草菌が持つIPMDHよりもはるかに耐熱性が高く、至適温度70~75℃の高度好熱菌Thermus thermophilusが持つIPMDHと比べても、わずかではありますがより高い温度まで安定であることが分かりました(図3)。また、様々な温度で酵素活性を調べたところ、祖先型IPMDHは活性の温度依存性が緩いため、常温付近では好熱菌酵素よりも大きい酵素活性を持ち、常温菌である枯草菌が持つIPMDHの常温での酵素活性の値に近いことが分かりました(図4)。今回の結果から、全生物の共通祖先よりも現代に近い祖先アミノ酸配列を再構成することによって、現存する好熱菌酵素よりも高い耐熱性を持ちながらも、常温での酵素反応に適した酵素を合成できることが分かりました。
合理的設計や進化分子工学と異なり、情報科学に基づく分子系統解析と実験科学の手法である遺伝子工学・タンパク質工学の技術を融合した今回の方法では、2つの祖先型酵素だけを作製しましたが、どちらも、当初の期待通りの性質を持っていました。つまり、最も古い祖先よりも現代に近い年代の酵素を復元することで、比較的簡単かつ効率的に耐熱性と常温活性を併せもった酵素を作製できることが分かりました。
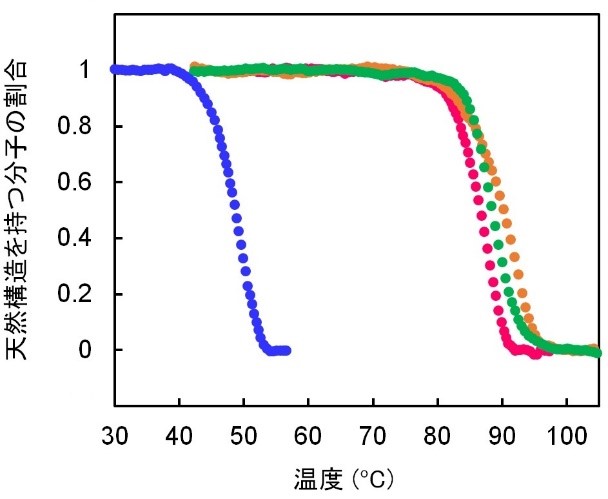
図3.祖先配列再構成により作成したancIPMDH-IQ(緑)とancIPMDH-ML(橙)および現存の好熱菌T. thermophilus由来IPMDH(赤)と常温菌である枯草菌IPMDH(青)の熱変性曲線の比較
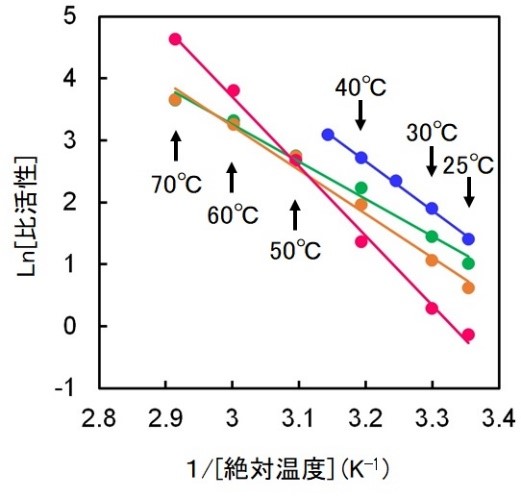
図4.祖先配列再構成により作成したancIPMDH-IQ(緑)とancIPMDH-ML(橙)および現存の好熱菌T. thermophilus由来IPMDH(赤)と常温菌である枯草菌IPMDH(青)の触媒活性の反応温度依存性。
4.研究の波及効果や社会的影響
生物が持つ生体触媒である酵素は、化学工業でしばしば用いられる無機触媒と比較して、1)鏡像異性体ですら100%識別可能な高い基質特異性、2)副生成物を生じさせない100%の反応特異性、3)常温・常圧で化学反応を促進できる低エネルギーコスト、4)容易にアミノ酸へと分解されるため環境負荷が小さい、といった優れた特徴を持っています。これらの利点を生かし、既に多くの遺伝子操作用酵素、多種の洗剤用加水分解酵素が使われ、プラスチック素材生産、医薬品製造、飲食料品製造等でも多くの酵素が利用され始めています。今回の研究から、生物の進化過程を遡る祖先配列再構成を用いることで、高い耐熱性と常温での十分な大きさの酵素活性を併せ持った、現存の天然酵素には稀な特性を持つ酵素を作製できることが分かりました。
情報科学と実験科学の融合による祖先配列再構成は、従来の酵素改変・設計技術である合理的設計法、進化分子工学的手法と比べて、比較的少ない実験量で高い常温活性を持つ耐熱性酵素を創出できることから、本研究の知見を基に、食品や飲料、紙・パルプ製品等の生産において有用な様々な酵素を創出することで、今後さらなる酵素利用の推進が期待されます。
また、本研究の発展により、持続可能な開発目標(SDGs)のうち、「7.エネルギーをみんなに そしてクリーンに」、「9.産業と技術革新の基盤をつくろう」、「13.気候変動に具体的な対策を」の達成への貢献が期待されます。
5.今後の課題
今回の研究からは、過去に遡ることで具体的にどのような酵素内の分子メカニズムの変化が起こり、高い耐熱性と常温での大きな酵素活性が達成できたのかは分かっていません。これを解明していくために、分子動力学計算や詳細な立体構造の解析が必要です。また、今回は真正細菌由来IPMDHの共通祖先配列のみを再構成しましたが、さらに現代に近い祖先配列を再構成することによって、異なった耐熱性と常温活性のバランスを持つ酵素が得られる可能性もあります。今後、さらに多くの祖先配列を再構成し、工業利用に最適な特性を持つ酵素の開発を試みていく予定です。
6.論文情報
雑誌名:Scientific Reports
論文名:Ancestral sequence reconstruction produces thermally stable enzymes with mesophilic enzyme‑like catalytic properties
執筆者名(所属機関名):古川龍太郎、當麻和香子、山崎浩司、赤沼哲史(早稲田大学)
DOI:10.1038/s41598-020-72418-4
本研究の一部は、早稲田大学特定課題研究「耐熱性と低温活性を両立した酵素の創成」(代表:赤沼哲史:2017K-291)の研究費助成を受けて実施しました。
【用語説明】
(注1) 酵素の半減期:酵素分子の半分が酵素活性を失うのに要する時間。酵素の安定性(耐久性)の指標の一つとして使われる。
(注2) 好熱菌:50℃以上の高温で生育する微生物。好熱菌の中でも生育上限温度が70℃を超える微生物を高度好熱菌、最適な生育温度が80℃以上の微生物を超好熱菌と呼ぶ。
(注3) 分子系統解析:現存の異なる生物が持つ同一の遺伝子(相同遺伝子)の塩基配列や、異なる生物が持つ同一のタンパク質(相同タンパク質)のアミノ酸配列(相同アミノ酸配列)を比較することによって、それらの遺伝子やタンパク質が、共通祖先遺伝子、あるいは、共通祖先タンパク質からどのような道筋で、どのように配列を変化させて進化してきたのかを調べること。
(注4) 進化系統樹:生物や遺伝子、タンパク質が進化してきた道筋を、樹木が根から幹、そして枝へと分岐していく様子になぞらえて描いたもの。根の位置が起源に相当し、枝の端が現在に相当する。
(注5) 全生物の最後の共通祖先:現存地球生物が持つ核酸塩基配列やタンパク質アミノ酸配列の種間比較から、地球生物の進化系統樹を作ることができる。この系統樹から、すべての地球生物は一つの共通祖先生物から進化してきたことがわかる。この共通祖先生物のことを「全生物の最後の共通祖先」と呼ぶ。全生物の最後の共通祖先は生命の起源、すなわち、地球上に最初に誕生した生物とは異なるので注意が必要である。
(注6) 真正細菌:地球のすべての生物を、タンパク質合成に関わるRNAの塩基配列の類似性に基づいて分類すると、大腸菌や乳酸菌、藍藻などの微生物が含まれる真正細菌の他に、メタン菌や超好熱性古細菌などが含まれる古細菌と、動物、植物、カビなどが含まれる真核生物の3つのドメインに分けることができる。それぞれのドメインは単系統群となり、それぞれのドメインに属するすべての生物種は、それぞれのドメインにおける共通祖先から進化したと考えられている。
(注7) イソプロピルリンゴ酸脱水素酵素(IPMDH):微生物や植物が持つ酵素。アミノ酸の1種であるロイシンの生合成に関わる。ニコチンアミドアデニンジヌクレオチド(NAD)を電子受容体として3-イソプロピルリンゴ酸を酸化的脱炭酸する反応を触媒する。NADから高価な還元型ニコチンアミドアデニンジヌクレオチド(NADH)をリサイクルする過程を含む工業プロセスに利用できる。







