光をあてたナノ粒子から出る「熱」で、
細胞毒性低く筋肉をワイヤレスに活性化する新手法を開発
在外研究拠点の活用で日、伊、シンガポールの若手研究者の専門知が結集
早稲田バイオサイエンスシンガポール研究所(WABIOS)の研究グループ(鈴木団(すずきまどか)主任研究員、新井敏(あらいさとし)次席研究員、Hou Yanyan研究補助員)は、イタリア技術研究所、シンガポール国立大学と共同で、細胞内に取り込まれたナノ粒子に光を当てることで、骨格筋の収縮をワイヤレスに誘導する新手法を開発しました。さらにこの反応は、生理的な収縮では必須となる細胞内カルシウムイオン濃度の上昇が起こらない、新しい収縮過程であることがわかりました。
再生医療や組織工学の分野では、さまざまな目的にあわせ、筋肉の細胞を刺激したり、筋肉の収縮を誘導したりするための方法が開発されてきました。多くは電気刺激によるものですが、与える電場が不均一になる、電極での電気分解で生じるイオンによる細胞毒性といった課題も残されています。そのため、電気刺激以外の手法を開発・検討することが望まれていました。
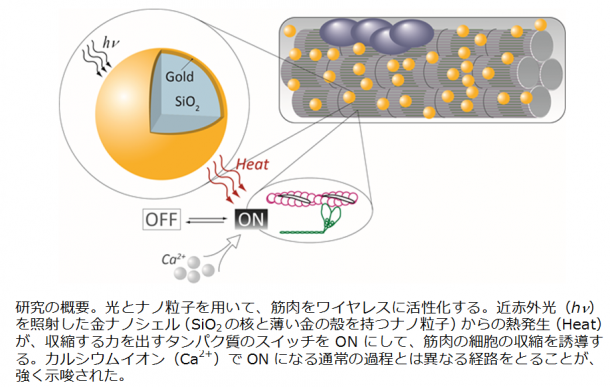
今回の研究では、金ナノシェルというシリカ(二酸化ケイ素SiO2)の核が、10 nmほどの薄い金で包まれた直径が約120 nmのナノ粒子を使用しました。金ナノシェルを取り込んだ細胞に特定の波長の近赤外光(約800nm)を照射すると、プラズモン効果と呼ばれる特殊な現象により熱が生じ、収縮する力を出すタンパク質のスイッチをONにして、筋肉の収縮を誘導します。本手法により、金ナノシェルのある細胞だけをワイヤレスに、選択的かつ同時に刺激することが可能になります。またこの波長の近赤外光は体液に吸収されにくいことから、生体の奥の細胞を刺激することも可能になると見込まれています。
今回の研究は、多くの細胞を同時に刺激することが求められる組織工学、再生医療や生体工学分野の実験系への広い応用が期待されます。
本研究成果は、アメリカ化学会(ACS)発行の『ACS Nano』のオンライン版に2017年1月20日に掲載されました。また、Nature Publishing Group発行の『Nature Nanotechnology』2017年3月号のNEWS AND VIEWSコーナーで紹介されました。
(1)これまでの研究で分かっていたこと
再生医療や組織工学、生物工学といった分野では、その様々な目的にあわせ、筋肉の細胞を刺激したり、筋肉の収縮を誘導したりするための方法が開発されてきました。多くは電気刺激によるもので、収縮だけでなく、培養条件にある未分化な細胞が筋肉細胞へ分化するのを誘導し、促進させる効果があることも示されています。しかし電気刺激も完全な方法ではなく、細胞外溶液に設置された電極の周囲に生じる電場が不均一になる、電極での電気分解で細胞毒性が起きる、といった重要な課題も残されています。電気刺激の他に、有効な方法は無いのでしょうか。
これまでに鈴木主任研究員らは、光学顕微鏡の下で水に良く吸収されるレーザー光を集光して、局所的な温度勾配を形成することで、心筋細胞(心臓も筋肉の一種で、心臓の拍動を生み出す筋肉細胞のことをこう呼びます)を熱で収縮させられることを示していました(Oyama, 2012)。そこで、「熱」刺激が、筋肉の収縮を誘導する新たな方法になる可能性が考えられました。
「熱」には別の良い点もありました。強い熱刺激に長時間さらされた細胞は死んでしまいますが、緩やかな熱刺激の場合は、例えば筋肉に豊富に含まれるミトコンドリアという細胞内小器官の産生が促されたり、高負荷運動時に筋肉が受けるダメージを軽減するタンパク質群の発現量が増えるといったことが知られていました。
ところが、赤外レーザーを集光させる方法では、1個の細胞は狙えても、広範囲に存在する任意の細胞を選択的に、同時に、そして任意のタイミングで刺激するのは難しく、またレーザー光が手前の細胞や体液に吸収されてしまうために、体の奥にある細胞を狙って刺激することができません。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと

左から鈴木主任研究員・Marino氏・Ciofani博士・Mattoli博士
そこで早稲田大学の在シンガポール研究所、早稲田バイオサイエンスシンガポール研究所(WABIOS)の研究グループ(鈴木団主任研究員、新井敏次席研究員、Hou Yanyan研究補助員)とイタリア技術研究所の研究グループ(Gianni Ciofani博士、Attilio Marino氏ら)、シンガポール国立大学のYoung-Tae Chang教授らは共同で、金ナノシェルを用いて筋肉の収縮をワイヤレスに活性化する新しい方法の開発を試みました。
本研究では鈴木主任研究員のグループ(専門:生物物理学、筋生理学、バイオイメージング)の光学顕微鏡を用いる計測技術を基礎とし、Ciofani博士、Marino氏らのグループ(専門:組織工学、生体材料工学)がナノ粒子の細胞応用を進め、さらに鈴木主任研究員のグループがChang教授(専門:化学、ケミカルバイオロジー)らとともにこれまで開発してきた細胞内温度イメージング技術(Arai, 2014; Itoh, 2016)を取り入れることで、筋肉の細胞の中で起きている出来事を詳細に理解することができました。日本、イタリア、シンガポールの若手研究者の専門性が融合することで得られた研究成果です。研究は、WABIOSで研究が進められる中で、次第にChang教授との共同研究へと発展していきました。この過程は、日本の大学がその在外研究拠点を活用することで、複数の地域をまたいだ国際的な研究活動の起点となりうることを示した一例ともいえます。
(3)そのために新しく開発した手法
鈴木主任研究員らは、金ナノシェルという微小な粒子を利用しました。シリカ(二酸化ケイ素SiO2)の核が、10 nmほどの薄い金で包まれた(「シェル(殻)」)、平均直径が約120 nmの粒子です。この粒子の特徴は、ある特定の波長の光(約800 nm。「近赤外光」と呼ばれる光の一種で、私たちの目では見えない。)を「プラズモン効果」と呼ばれる特殊な現象によって高い効率で吸収し、光のエネルギーを熱へ変換する点にあります。この波長の近赤外光は、生体試料の主成分である水への吸収が少ない色をしています。そのため生体の奥にも光が届き、この金ナノシェルのある場所だけを加熱できると期待されます。
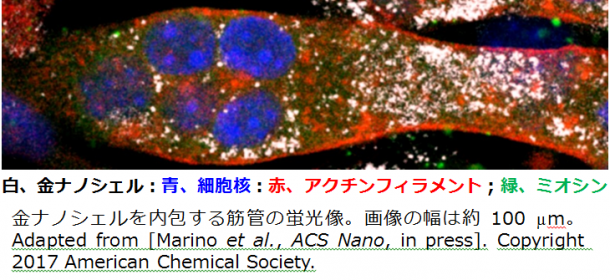
金ナノシェルは培養細胞の一つであるC2C12細胞へ十分に取り込まれること、また筋管(骨格筋と同様に細胞が融合して、一つの細胞の中に複数の細胞核が存在する「多核」の状態となり、また収縮タンパク質が抱負に作り出されて収縮できるようになる)へ分化誘導しても金ナノシェルは細胞内の細胞質に存在し、細胞への毒性が実験上は十分に低いことが確認できました。これら、金ナノシェルを取り込んだ筋管を温度イメージングしながら細胞の応答を観察しました。
(4)今回の研究で得られた結果及び知見
三つの発見がありました。一つは、光をあてた金ナノシェルから生じた熱で細胞内の温度が上がり、同時に筋管が収縮したことです。このような変化は、金ナノシェルの無い筋管に近赤外光を照射しただけでは見られませんでした。二つ目の発見は、生理的な収縮、あるいは電気刺激による収縮では必須となる細胞内カルシウムイオン濃度の上昇が起こらない、新しい収縮過程であることが、条件を変えて行った複数の実験結果から示唆されたことでした。以上の結果から、近赤外光を受けた金ナノシェルが熱を発生させ、細胞内の温度が上昇し、それが収縮するタンパク質のスイッチをONにして、筋管の収縮を引き起こした、と考えられました。
そして三つ目の発見は、緩やかで継続的な熱刺激が、骨格筋への分化誘導にとって有利に働く可能性が示されたことでした。金ナノシェルを取り込んだC2C12細胞を筋管へ分化させながら、5日間にわたる断続的な近赤外光刺激を与えたところ、熱の負荷に対する耐性を向上させる遺伝子、およびミトコンドリア産生に関わる遺伝子の発現量が顕著に増加していました。これは、骨格筋の分化成熟過程にとって、ゆるやかな熱刺激が有効であることを示唆していました。
(5)研究の波及効果や社会的影響
金ナノシェルへの近赤外光照射による熱発生を利用し、細胞内温度を緩やかに上げることで、カルシウムイオンの濃度変化を伴わずに骨格筋の収縮を誘導する方法を提案しました。光とナノ粒子を用いて筋肉を「ワイヤレス」に活性化するこの方法は、一般に、多くの細胞を同時に刺激することが求められる組織工学、再生医療や生体工学分野の実験系への広い応用が期待されます。
(6)今後の課題
今回の実験条件では顕著な毒性は見られませんでしたが、この方法を広く応用していくにあたり、金ナノシェルの毒性についてはより慎重に検討する必要があります。また狙った骨格筋細胞だけを刺激するためには、金ナノシェルをその骨格筋細胞へ送り届ける仕組みが必要となり、そのような技術に特化して開発が進められているドラッグデリバリーシステムなどとの連携が求められます。本手法の有効性は、最終的には動物モデルを用いて検討されるまでわかりませんが、またさらに、継続的な光熱刺激がミトコンドリア産生や骨格筋分化誘導に与える影響について、技術開発の新しい方向性を提案するものと考えられます。
(7)100字程度の概要
光とナノ粒子で筋肉をワイヤレスに活性化する新しい手法を開発。通常は必要なカルシウムイオン無しに、光を受けた金ナノシェル(シリカの核と薄い金の殻を持つナノ粒子)から発生した熱だけで筋肉の細胞が収縮する。
論文情報
- 掲載誌:アメリカ化学会 American Chemical Society(ACS)ACS Nano
- 論文名:Gold Nanoshell-Mediated Remote Myotube Activation
- 著者:Attilio Marino(イタリア技術研究所)*, Satoshi Arai(早稲田大学), Yanyan Hou(早稲田大学), Andrea Degl’Innocenti(イタリア技術研究所), Valentina Cappello(イタリア技術研究所), Barbara Mazzolai(イタリア技術研究所), Young-Tae Chang(シンガポール国立大学), Virgilio Mattoli(イタリア技術研究所), Madoka Suzuki(早稲田大学、JSTさきがけ)*, Gianni Ciofani(イタリア技術研究所)* (*Corresponding authors)
- オンライン版掲載URL:http://pubs.acs.org/doi/abs/10.1021/acsnano.6b08202
参考文献
- Arai, S., Lee, S.-C., Zhai, D., Suzuki, M. and Chang, Y.-T. A molecular fluorescent probe for targeted visualization of temperature at the endoplasmic reticulum. Sci. Rep., 4, 6701 (2014)
- Itoh, H., Arai, S., Sudhaharan, T., Lee, S.-C., Chang, Y-T., Ishiwata, S.,* Suzuki, M.* and Lane, E. B.* Direct organelle thermometry with fluorescence lifetime imaging microscopy in single myotubes. Chem. Commun., 52, 4458-4461 (2016) 「筋管細胞の温度変化を蛍光イメージングで計測 熱産生が関わるメタボリックシンドローム等の治療に期待」
- Oyama, K., Mizuno, A., Shintani, S.A., Itoh, H., Serizawa, T., Fukuda, N., Suzuki, M.* and Ishiwata, S.* (*Corresponding authors) Microscopic heat pulses induce contraction of cardiomyocytes without calcium transients. Biochem. Biophys. Res. Commun., 417, 607-612 (2012)