染色体を次世代に継承する基盤である「動原体」を維持する仕組みを発見
発表のポイント
- 動原体を構成するタンパク質のひとつであるMis6(ヒトCENP-I)が、動原体の土台となるCENP-Aタンパク質の維持に必要な役割を担うことを発見し、染色体を次世代へと継承するための基盤となる「動原体」が安定的に維持される仕組みを明らかにした。
- ヒトと同じ真核生物である分裂酵母をモデル生物として、動原体を維持するメカニズムの解明に挑んだ。
- 今回の研究を皮切りとして、CENP-Iとがん細胞との関係性を探ることで、CENP-Iを標的としたがん治療薬の開発などに結びつくことが期待される。
概要
早稲田大学大学院先進理工学研究科博士課程(研究当時)の平井 隼人(ひらい はやと)および博士課程1年の正垣 佑樹(しょうがき ゆうき)、同大理工学術院の佐藤 政充(さとう まさみつ)教授による研究グループは、染色体を次世代に継承するための基盤となる動原体※1を安定的に維持するしくみを発見しました。動原体が正しく形成されない場合、あるいは動原体が崩壊してしまう場合には、染色体が不均等に分配されるリスクが高まり、細胞のがん化を引き起こす可能性があります。本研究により、染色体を均等に分配するための普遍的で重要なシステムが明らかになったことで、このシステムを標的とした新たながん治療薬の開発などにも結びつくことが期待されます。
本研究成果は、Nature Researchが提供するオープンアクセス・ジャーナル『Communications Biology』にて、2022年8月15日(月)にオンラインで掲載されました。

概要図 : 染色体を次世代へと継承するための基盤となる「動原体」を維持するしくみ
(1)これまでの研究で分かっていたこと
私たちヒトの身体は約37兆個の細胞から構成されていますが、もともとは1つの細胞 (受精卵) が細胞分裂を繰り返して今に至ります。それぞれの細胞が同一の遺伝情報を保持するためには、あらかじめ複製された染色体が均等に娘細胞※2へと分配される必要があります。その際、染色体が不均等に分配された細胞はがん細胞となる場合があります。したがって、染色体分配を正確におこなうために、どのような遺伝子がどのように働くのかを解明することが、遺伝子を標的としたがん治療の観点からも非常に重要です。
複製された染色体を2個の娘細胞に正確に分配するためには、「動原体」と「微小管」※3の存在が欠かせません。染色体上には動原体と呼ばれる構造が形成されており(図1の赤)、その動原体に微小管(図1の緑)が結合して、染色体を両極に向けて引っ張ることで分配が完了します。したがって、動原体が正しく形成されない場合、あるいは形成された動原体が崩壊してしまう場合には、染色体の分配は異常になってしまいます。

図1:(左)染色体分配は、染色体上の動原体に微小管が結合して上下両極へと引っ張ることで起きる。(右)その基盤となる動原体は、DNAが巻き付くCENP-Aタンパク質を土台として形成される。
動原体は約100種類のタンパク質から構成されていますが、その土台となるのは、CENP-A※4と呼ばれるヒストンタンパク質です (図1)。仮に、CENP-Aが染色体上から失われると、動原体の形成不全を引き起こし染色体が不均等に分配されます。つまり、染色体上の正しい位置に正しい量のCENP-Aが存在することが、動原体形成ひいては正確な染色体分配のために必須となります。
さて、これまでに、正しい位置に正しい量のCENP-Aが供給される仕組みについては研究が進展してきました。しかしながら一度供給されたCENP-Aがその場で安定的に維持される仕組みと、それに関する因子が存在するか明らかになっていませんでした。このようなCENP-Aを維持する仕組みもまた、動原体を保つために必要になるはずです。このような動原体を維持するメカニズムは、私たちヒトが受精卵1細胞から約37兆個の細胞にまで分裂を繰り返す中でも、破られることなくきっちりと守られてきた、普遍的な重要性をもつシステムだと言えます。そこで、ヒトと同じ真核生物である分裂酵母※5をモデル生物として、このしくみの解明に挑みました。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
今回、動原体を構成するタンパク質のひとつであるMis6 タンパク質(ヒトCENP-I)※6がCENP-Aを安定的に動原体部位に維持するために必要な役割を担うことを発見しました。専門的には、Mis6とCENP-Aを介したエピジェネティック※7な制御により正確な動原体の形成がおこなわれると言えます。
CENP-Aを蛍光タンパク質GFP※8を用いて可視化して経時的に観察すると、野生型の細胞ではCENP-Aが失われることなく維持され続けることがわかりました。一方で、Mis6の機能を失った変異体を用いて同様の観察を行うと、CENP-Aが徐々に染色体上から失われることがわかりました(図2)。では、Mis6は具体的にどのようにしてCENP-Aの維持に寄与するのでしょうか?
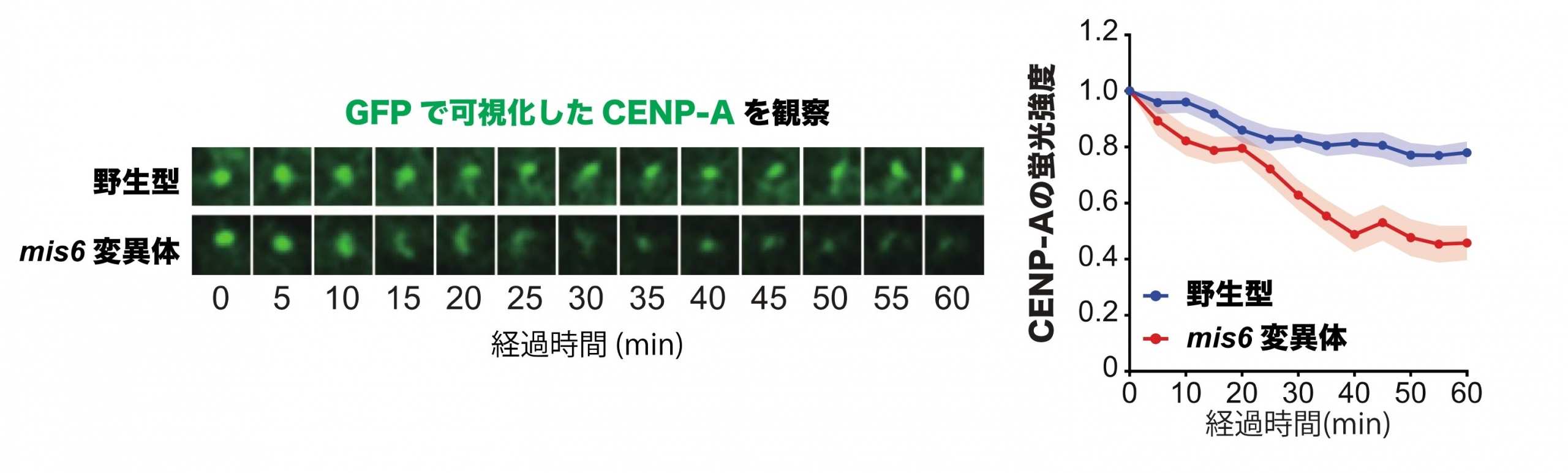
図2 :(左)GFPで可視化したCENP-Aの観察図、(右)CENP-Aの蛍光強度を経時的に測定したグラフ
先行研究において、CENP-Aが組み込まれた染色体領域(セントロメア領域※9)からのRNA転写を人工的に過剰に起こすと、その領域からCENP-Aが失われることが報告されています。これらをもとに推測すると、Mis6はセントロメア領域に存在して、そこでの過剰な転写を防ぐことでCENP-Aを維持することが予想されました(図3、上)。実際に、Mis6の機能を失った変異体では、転写装置であるRNAポリメラーゼII※10がセントロメア領域に多く集積していました。また、RNAポリメラーゼの働きを抑える阻害薬の存在下では、変異体においてもCENP-Aが染色体上で維持され続けていました。これらの実験結果は、セントロメアにおけるMis6の機能が失われると同領域内にRNAポリメラーゼIIが集積してRNAの転写を引き起こしてしまい、その際に、DNAに結合したCENP-Aを取り外してしまうことを意味しています(図3、下)。

図3:(上)Mis6がCENP-Aを安定的に維持するモデル図、(下)Mis6はRNAポリメラーゼIIによる過剰な転写を防ぐことでCENP-Aの維持に寄与することがわかった。Mis6が機能しない細胞においては、セントロメア領域の転写が進み、CENP-Aが取り外され、維持されない。
以上の結果から、動原体タンパク質Mis6はRNAポリメラーゼIIによる過剰な転写を抑止することでCENP-Aを安定的に維持すると結論づけました(図3、上)。
(3)研究の波及効果や社会的影響
私たち研究グループは以前に、染色体上にCENP-Aを「供給」する新規因子を発見していました。そして今回の研究では、供給されたCENP-Aを失わないように「維持」するしくみと、それを司る因子を発見することができました。そもそも、Mis6(CENP-I)はCENP-Aを「供給」する因子だと考えられていましたが、今回の私たちの研究成果は、Mis6の未知の機能を見いだしたものです。
細胞は何回分裂を繰り返しても、染色体のセントロメア領域が動原体の形成場所として維持されたまま、継承されていきます。そしてそれは親の代から子の代へと世代を受け継ぐ際も同じで、世代を超えても染色体のセントロメア領域が常に動原体として引き継がれます。専門的に言えば、動原体は世代を超えてエピジェネティックに受け継がれています。これは、いかなる場面でもCENP-Aが失われずに「維持」されることと密接に関係しており、本研究によって、CENP-Aを維持する機構が明らかになったことで、動原体のエピジェネティクスのしくみが解明できつつあると将来を展望しています。
また、近年の研究で、胃がんや乳がん細胞ではヒトCENP-I(分裂酵母Mis6)が過剰に発現していることが報告されています。私たちが今回明らかにしたメカニズムと合わせて考えると、CENP-I(Mis6)の異常な過剰発現によって、染色体上の正しい位置に正しい量のCENP-Aが存在すべきだというバランスが崩れてしまい、染色体の分配が異常になり、最終的にがん化につながったと考えられます。がん化のメカニズムには様々なものがありますが、この場合は過剰なCENP-Iの作用を抑えてあげることで、がん化を阻止することができるかもしれません。今回の研究を皮切りに、CENP-Iとがん細胞との関係性を探ることで、CENP-Iを標的としたがん治療薬の開発などに結びつくことが期待されます。
(4)今後の課題
今回新たに発見した、Mis6によってCENP-Aを維持するメカニズムが、ヒトなどの高等生物にも保存されているかを調べたいと考えています。また、前述のように、CENP-I(Mis6)ががん化を引き起こす可能性についてさらに検証し、メカニズムを解明しながら、CENP-Iを治療標的とした創薬科学にも発展させていきたいと考えています。
(5)研究者からのコメント
世界中の研究者の多くがCENP-Aを「供給」する仕組みについて調べる中、あえてニッチな「維持」する仕組みに目を向けて研究を粘り強く続けてきました。その結果、意外な因子が意外な方法でCENP-Aを維持しているという、非常に重要な発見をすることが出来たと考えています。
(6)用語解説
※1 動原体
染色体の中央部分に形成される巨大なタンパク質複合体で、分裂期に微小管が結合する場所となる。
※2 娘細胞
1つの細胞が分裂して生じた2つの細胞のこと。
※3 微小管
細胞の種類や時期によって柔軟に形を変える繊維状の構造体。ときには物質輸送のためにレールとして働き、ときには染色体上の動原体に結合して染色体分配装置として働く。
※4 CENP-A
DNAはヒストンと呼ばれるタンパク質に巻き付いて細胞の核内に効率よく格納されている。ヒストンはH2A、H2B、H3、H4の4種類から構成されるが、それぞれのヒストンにはバリアントと呼ばれる亜種が存在する。CENP-AはヒストンH3のバリアントで動原体を形成するための足場となるタンパク質である。
※5 分裂酵母
ヒトと同じ真核生物で、古くからモデル生物として用いられてきた。1回の細胞分裂が3時間と短く、染色体分配に関する研究を行うのに優れている。また、生存に必須な多くの遺伝子がヒトと分裂酵母の間で保存されている。
※6 動原体タンパク質Mis6(ヒトCENP-I)
動原体の中でも内側 (染色体側) に局在するタンパク質。機能が欠失した変異体ではCENP-Aが失われるが、Mis6とCENP-Aの具体的な関係については明らかになっていなかった。
※7 エピジェネティック(エピジェネティクス)
一般的には、DNAに書き込まれている塩基配列(A, C, G, Tの並び)がいわば目印となり、それに沿って染色体の状態がコントロールされている。このようなしくみをジェネティクス(遺伝学的なもの)と呼ぶのに対して、DNA配列に依らずに染色体の状態がコントロールされるしくみが存在する。これは近年明らかになってきたしくみで、このしくみをエピジェネティクスと呼ぶ。今回の場合、CENP-Aが染色体の特定の部位に維持される際にはその部位のDNA塩基配列に依らないので、CENP-Aはエピジェネティックに特定部位に維持される、といえる。
※8 GFP
Green fluorescent protein (緑色蛍光タンパク質) の略。下村脩博士がオワンクラゲから単離したタンパク質で、現在では研究対象となるタンパク質にGFPを融合することで、細胞内での局在を観察するのに用いられている。
※9 セントロメア
CENP-Aが供給され、動原体が形成される染色体の領域。
※10 RNAポリメラーゼII
DNAからRNAを転写する装置。真核生物には3種類のRNAポリメラーゼが存在し、RNAポリメラーゼIIはタンパク質に翻訳されるmRNAを主に転写する。
(7)論文情報
雑誌名:Communications Biology
論文名:The Mis6 inner kinetochore subcomplex maintains CENP-A nucleosomes against centromeric non-coding transcription during mitosis
執筆者名(所属機関名):平井 隼人 1,2、正垣 佑樹1、佐藤 政充1,3,4
1. 早稲田大学 大学院先進理工学研究科 生命医科学専攻
2. 東京大学 大学院総合文化研究科 広域科学専攻
3. 早稲田大学 先端生命動態研究所
4. 早稲田大学 構造生物・創薬研究所
掲載日:2022年8月15日(月)
掲載URL:https://doi.org/10.1038/s42003-022-03786-y
DOI:10.1038/s42003-022-03786-y
(8)研究助成
研究費名:文部科学省 新学術領域研究
研究課題名:分裂酵母CENP-Aヌクレオソームと動原体の再構築
研究代表者名(所属機関名):佐藤 政充