すべての生物は細胞分裂によって成長・増殖します。細胞分裂(=自己複製機能)は生命の定義とも言える、生物にとって必要不可欠な機能であり、その仕組みの究明は生物学・医学における最重要課題のひとつです。我々ヒトを含む動物細胞は、分裂期になると細胞膜の内壁に収縮環と呼ばれるリング状のバンドル構造をつくります。このリングが収縮し、細胞膜を巾着のようにくびり切ることで細胞は分裂します。これまでの分子細胞生物学的研究から、収縮環を構成するタンパク質や、収縮環の形成を制御するタンパク質が徐々に明らかになってきました。しかし、収縮環が自己組織的に形成される仕組みについては、未解明な部分が多く残されています。
今回、理工学術院の宮崎牧人(みやざきまきと)次席研究員と石渡信一(いしわたしんいち)教授(先進理工学部物理学科、早稲田大学バイオサイエンスシンガポール研究所所長)らの研究グループは、細胞から単離・精製したタンパク質を混ぜ合わせて細胞を模したカプセルに封入し、収縮環様のリング構造を再構築することに世界に先駆けて成功しました。さらに、細胞質分裂を担う収縮環の自己組織化と、その収縮に必要な最小限の構成要素と物理的条件を明らかにしました。この成果は、細胞分裂の仕組みの全容を解く重要な手掛かりになると期待されます。
細胞分裂の仕組みの詳細が明らかになれば、将来的には細胞分裂を自在に制御することが可能になり、癌細胞の分裂の抑制や、正常細胞の分裂促進による各種疾患治療、再生医療など、さまざまな医療分野への貢献が期待されます。また、今回の研究成果を応用することで、自己増殖機能を備えた人工細胞をつくりだす可能性もあります。
なお、今回の研究成果は、英国科学誌『Nature Cell Biology』オンライン版に、3月23日午後4時(現地時間)に掲載されました。
論文題目:
Cell-sized spherical confinement induces the spontaneous formation of contractile actomyosin rings in vitro
「細胞サイズの球状閉鎖空間は、in vitro(注1)で収縮性のアクトミオシンリングの自発形成を誘発する」
注1:In vitroは「試験管内で」という意味。細胞から取り出したタンパク質などを混ぜ合わせた人工的な実験系を指す。
細胞分裂装置(収縮環)の形成メカニズムの一端を解明
―癌細胞の分裂抑制や再生医療への貢献に期待―
(1)これまでの研究で分かっていたこと(科学史的・歴史的な背景など)
大腸菌などの原始的な単細胞生物から多細胞の昆虫、哺乳類に至るまで、すべての生物は細胞分裂によって成長・増殖します。細胞分裂(=自己複製機能)は生命の定義とも言える、生物にとって必要不可欠な機能であり、その仕組みの究明は生物学・医学における最重要課題のひとつです。
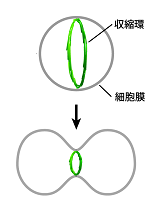
図1
我々ヒトを含む動物細胞は、分裂期になると細胞膜の内壁に収縮環と呼ばれるリング状のバンドル構造をつくります。収縮環は主にアクチン繊維とミオシン分子モーターから構成されており、ミオシンがアクチン繊維間に張力を発生させることでリングが収縮し、細胞膜を巾着のようにくびり切ることで細胞は分裂します(図1)。これまでの分子細胞生物学的研究から、収縮環を構成するタンパク質や、収縮環の形成を制御するタンパク質が徐々に明らかになってきました。しかし、収縮環が自己組織的に形成される仕組みについては、未解明な部分が多く残されています。
図1:動物細胞が分裂する仕組み。収縮環と呼ばれる、アクチン繊維を主体とするリング状のバンドル構造の収縮により細胞は分裂する。収縮環形成のメカニズムは不明。
収縮環はどのような仕組みで形成されるのでしょうか?これまでの研究から、数十種類ものタンパク質が関与していることが示唆されていますが、収縮環形成に必須な最小限の要素は何かが良くわかっていません。
今日に至るまで30年以上もの間、収縮環形成に関する研究は細胞を用いて行われてきました。しかし、前述したように数十種類ものタンパク質が収縮環形成に関与していると考えられており、しかもそれらのタンパク質は多機能で複雑に相互作用し合っていると考えられています。従って、どのタンパク質のどのような機能が収縮環形成に必須であるのか、最小限の要素を特定するのは従来の細胞を用いた研究では難しいと私たちは考えました。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
私たちは収縮環形成に関与していると考えられているタンパク質を細胞から単離・精製した後、それらを再度混ぜ合わせて細胞を模したカプセルに封入し、収縮環様のリング構造が再構築される条件を探る、という斬新なボトムアップ的手法を用いて収縮環の形成メカニズムに迫りました。その結果、収縮環の主構成タンパク質であるアクチンとミオシンに、アクチン繊維の束化因子を加えた、たった3種類の構成要素だけでも、細胞サイズのカプセル内では収縮環様のリング構造が自発的に形成され、しかもそれが収縮することを発見しました。
(3)そのために新しく開発した手法
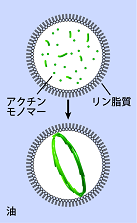
図2
収縮環の主構成タンパク質であるアクチンとミオシンを細胞から単離・精製し、それらを再度混ぜ合わせて微小カプセル(油中液滴)に封じ込めた人工細胞系を構築しました(図2)。液滴内壁には細胞膜の主成分であるリン脂質分子を並べて、細胞内環境を模倣しました。
この実験系は、アクチンとミオシンそれぞれの濃度や活性などの生化学的パラメータと、液滴の大きさなどの物理的パラメータを、独立かつ精密に制御することが可能です。さらに、収縮環形成に関与していると考えられているタンパク質を添加することで、そのタンパク質の寄与を明らかに出来ます。細胞を圧倒的に単純化したモデル実験系の構築によって、収縮環様の構造形成に必要な要素と条件を定量的に調べることが可能になりました。
図2:宮崎次席研究員らが構築した人工細胞系の模式図。細胞から単離したタンパク質を混ぜ合わせて細胞サイズのカプセル(油中液滴)に封入し、収縮環様の構造が自己組織化される条件を探った。
(4)今回の研究で得られた結果及び知見

図3:収縮環様のリング構造の自己組織化と収縮。白い点線は液滴と油の境界を表す。(a) 液滴内で自己組織化した構造の蛍光顕微鏡写真。タンパク質を液滴に封入してから1時間後の様子を示す。小さな液滴内(黄色の矢印で示した)では収縮環様のリングが液滴の赤道上に形成されることがわかった。 (b) 液滴内で自己組織化したリングが収縮する様子。写真に記載した時間はタンパク質を液滴に封入してからの経過時間。
アクチン、ミオシンとアクチン繊維の束化因子をさまざまな大きさの液滴に封入し、液滴の中でアクチン繊維を重合させると、20マイクロメートル以下の大きさの液滴内ではリングが自己組織化されることを発見しました(図3a)。細胞の大きさは通常10〜20マイクロメートル(注2)です。従って、私たちの発見したリング形成は細胞サイズの微小空間でのみ生じる特徴的な現象であると言えます。さらに、アクチン繊維上のミオシン密度が上昇するとリングが自発的に収縮することを発見し(図3b)、リングの収縮速度が直径に比例するという、収縮環の基本的性質を満たしていることを確認しました。
リングはほぼ100%の確率で液滴の赤道面内に形成されました。細胞サイズの微小閉鎖空間ではアクチン繊維は曲がりづらいため、屈曲率が最小になる赤道上にアクチン繊維が集積してリングが形成されたと考えられます。この結果は、細胞はアクチン繊維の剛性という物理的効果を利用して収縮環を形成させていることを示唆するだけなく、細胞の中央を認識して等分割する仕掛けに、アクチン繊維の剛性を利用していることも示唆しています。
注2:1マイクロメートルは1000分の1ミリメートル。
(5)研究の波及効果や社会的影響
私たちは細胞から単離・精製したタンパク質を混ぜ合わせて収縮環様のリング構造を再構築することに世界に先駆けて成功し、細胞質分裂を担う収縮環の自己組織化と、その収縮に必要な最小限の構成要素と物理的条件を明らかにしました。この成果は、細胞分裂の仕組みの全容を解く重要な手掛かりになると期待されます。
細胞分裂の仕組みの詳細が明らかになれば、将来的には細胞分裂を自在に制御することが可能になるでしょう。そのような技術が確立されれば、癌細胞の分裂の抑制や、正常細胞の分裂促進による各種疾患治療、再生医療など、さまざまな医療分野への貢献が期待されます。また、私たちの成果を応用することで、自己増殖機能を備えた人工細胞も造れるようになるかもしれません。
(6)今後の課題
私たちは、たった3種類の構成要素だけでも収縮環様の構造が自発的に形成されることを発見しました。しかし、上述したように、実際の細胞内では数十種類ものタンパク質が収縮環の形成に関与していると考えられています。それらのタンパク質にはどのような役割があるのでしょうか?
私たちの体は数十兆個もの細胞から出来ていますが、それはたった一つの受精卵が細胞分裂を繰り返した結果であり、その過程で分裂の失敗は許されません。従って、細胞にはあらゆる状況でも正確かつ確実に分裂するための巧妙な仕掛けがあるはずであり、正確性と頑強性の維持にはさまざま種類のタンパク質が連携して働いていると考えられます。細胞分裂に関与していると考えられているタンパク質が、それぞれどのような機能を持っているのか、ボトムアップ的手法を用いてひとつずつ明らかにしていくことが今後の課題です。
著者
宮﨑 牧人 早稲田大学理工学術院次席研究員
千葉 雅隆 早稲田大学大学院先進理工学研究科修士課程修了(2013年度)
江口 宙輝 早稲田大学大学院先進理工学研究科修士課程2年
大木 高志 早稲田大学理工学術院次席研究員
石渡 信一 早稲田大学理工学術院教授・早稲田大学バイオサイエンスシンガポール研究所所長







