囊胞腎(のうほうじん)の形成に関わる新たな遺伝子を発見
発表のポイント
- 嚢胞腎※1において、微小管※2結合タンパク質CAMSAP3※3の変異遺伝子が嚢胞を形成していることを発見した。
- CAMSAP3が変異すると、微小管の整列に異常が生じ嚢胞の形成を引き起こすこと、老化とともに嚢胞の範囲が拡大していくことを見出した。
- 難病に指定されている多発性囊胞腎の予防法や治療法の確立に繋がることが期待される。
早稲田大学理工学術院の戸谷 美夏(とや みか)准教授および佐藤 政充(さとう まさみつ)教授、理化学研究所生命機能科学研究センター(BDR)竹市 雅俊(たけいち まさとし)客員主管研究員(研究当時:高次構造形成研究チームリーダー)らの研究グループは、尿細管が肥大化して内部に水分がたまる病変である嚢胞腎において、微小管結合タンパク質CAMSAP3(カムサップスリー)の変異遺伝子が嚢胞を形成していることを発見しました。
CAMSAP3が変異すると、微小管の整列に異常が生じ嚢胞の形成を引き起こすこと、また老化とともに嚢胞の範囲が拡大していくことを見出しました。本研究成果は、難病に指定されている多発性囊胞腎の予防法や治療法の確立に繋がることが期待されます。
本研究成果は、2021年3月12日(金)にSpringer Nature社『Scientific Reports』のオンライン版で公開されました。
(1)これまでの研究で分かっていたこと
腎臓には多数の尿細管※4が存在しています。尿のもととなる原尿は、尿細管の中を通る過程で体外に排泄する成分の調整をおこなうことが知られています。尿細管を構成するのは上皮細胞※5であり、原尿はそれに接する上皮細胞と物質のやり取りをおこないます。
近年、国民病として注目を集める腎臓病の中でも、尿細管が肥大化して内部に水分がたまる病変は嚢胞腎と呼ばれ、腎臓全体に多数の囊胞が形成される遺伝性の病気も知られています。難病に指定されている多発性囊胞腎では、PKD1 、PKD2遺伝子が原因として知られています。これらに変異があると、上皮細胞に生える毛のような構造(繊毛)の形成不全を引き起こし、その結果、尿細管が肥大化することが分かっています(図1)。
尿細管の肥大化は、それを構成する上皮細胞の形が変形して、かつ異常に増殖して起きると考えられます。しかし、尿細管が肥大化する具体的な分子メカニズムは不明な点が多く、PKD1、PKD2遺伝子以外に多発性嚢胞腎の病態に関わる遺伝子があるのかなど、未解明の部分が多く残っています。
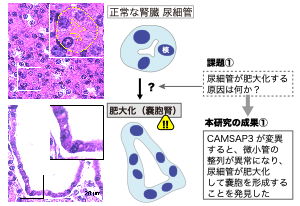
図1:正常な腎臓の尿細管(上)と、肥大化して嚢胞を形成した異常な尿細管(下)
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
嚢胞腎の全容を解明して予防・治療方法を確立するために、さらなる基礎研究の重要性が指摘されています。そこで、本研究グループはマウスにおける上皮細胞の研究に取り組みました。
本研究ではまず、上皮細胞内の微小管を制御する因子であるCAMSAP3タンパク質の機能が欠損すると、嚢胞腎に見られる尿細管の異常な肥大化が起きることを発見しました(図1)。これは、これまで知られていなかった新しいタイプの囊胞腎形成のしくみの発見であり、さらには、上皮細胞の微小管が哺乳動物の体でどのような役割をもつのかが明らかになった世界で初めての例と言えます。
これまでにマウスの小腸の研究から、CAMSAP3タンパク質は上皮細胞の内部に形成される微小管を一方向(尿細管の内側から外側への方向)に整列させるために必須の因子であることを、早稲田大学の戸谷 准教授(研究当時: 理化学研究所BDR研究員)・理化学研究所の竹市客員主管研究員らは明らかにしていました。そこで本研究グループは、CAMSAP3変異マウスでは細胞内の微小管の整列に異常が発生し、これが腎臓における嚢胞の形成を引き起こすと考え、両者の間にどのような因果関係が存在するのかを、マウスの研究から明らかすることを考えました(図2)。その結果、CAMSAP3変異マウスにおいて嚢胞をつくる上皮細胞では、物理的な圧力を感知する「メカノセンサー」※6と呼ばれる転写に関わる因子YAPやPIEZO1が活性化していることを見出しました(図2)。
尿が尿細管を通過する際には、その壁である上皮細胞に圧力を与えます。正常マウスでは、微小管がクッションの働きをして圧力を和らげることで尿細管の形状を維持しますが、CAMSAP3変異マウスでは微小管の整列が乱れてクッションの働きができずに、尿から受ける圧力を大きくしてしまいます。その結果、YAP、PIEZO1が活性化され、増殖を促す遺伝子の発現が誘導されて尿細管が肥大化したと考えられます。
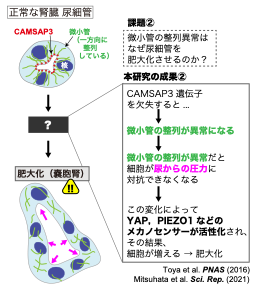
図2:CAMSAP3変異マウスの腎臓において尿細管が嚢胞を形成するメカニズム
(3)そのために新しく開発した手法
ZEISS社のLSM超解像顕微鏡を利用して、尿細管の中の微細な微小管構造を明確に可視化することに成功し、これにより、CAMSAP3変異マウスでは微小管の異常とそれに伴う嚢胞の形成が見られることを実証しました。
また、理化学研究所生命機能科学研究センター(BDR)生体モデル開発チームとの共同研究により、CRISPR/Cas9を用いたCamsap3遺伝子の完全長ノックアウト(KO)マウス※7を作製することに成功しました。これにより遺伝子と病変の関係性を完全に立証することができました。
(4)研究の波及効果や社会的影響
今回の研究成果は、細胞内の構造が腎臓の構造を維持するためにどのように働くのかを示した希有の知見であると言えます。本研究グループは、これまで知られていた繊毛の異常に基づく嚢胞の形成とは別に、微小管の整列に異常が生じると嚢胞の形成を引き起こすこと、さらに、その症状は胎子の頃から見られるものの、出生後、老化とともに嚢胞の範囲が拡大していくことを見出しました。ヒトにおいて多発性嚢胞腎が緩徐的に進展することから考えて、CAMSAP3の変異遺伝子はヒトの嚢胞腎を引き起こす原因の一つである可能性があり、予防法や治療法の確立に繋がることが期待されます。
また、年齢とともに症状が顕著になる生活習慣病との相互関連を調べることで、生体恒常性を司るコントロールセンターとしての腎臓の重要性をさらに立証することになると考えます。
(5)今後の課題
微小管がどのように細胞にかかる圧力を感知するのか、さらなる分子メカニズムを追究することで、嚢胞形成のメカニズムを力学的・分子生物学的に記述することができるようになると考えます。既知の嚢胞腎モデルマウスにおいて、CAMSAP3の働きや細胞内の微小管の整列に異常が見られるかを調べることから、既知の嚢胞腎因子との関連性を知ることも重要だと考えます。
(6)研究者のコメント
私たちの体は37兆個もの細胞からなると言われます。細胞の中に存在するどんな小さな構造物も、体を維持するためにしっかりと働いていること、私たちの理解がまだ及んでいない、その精緻なしくみの一端を知るたびに感動します。基礎研究の成果から、疾患の原因に対する新たな理解や、克服への新たなヒントが生まれたらと願っています。
(7)用語解説
※1 (多発性)嚢胞腎
囊胞腎はよく見られる病変で、50才以上のヒトの半数が腎囊胞をもつとも言われる。囊胞は、片側に1つのみ形成されるもの、複数の囊胞が形成されるもの、左右両側に形成されるものなど、さまざまな形状を示す。多くは症状を示さない良性のものとされるが、多発性囊胞腎を含むいくつかの遺伝的な病気と、それを引き起こす原因遺伝子が知られる。多くの囊胞腎では、遠位尿細管・集合管(※4参照)に囊胞を形成するが、CAMSAP3変異マウスでは、近位尿細管に形成される。多発性囊胞腎は尿細管の全領域に囊胞を形成する。
※2 微小管
細胞内で繊維状の構造をとる細胞骨格の一つ。細胞の種類や役割によって、細胞内で、繊維の編成が整然と制御されている。染色体の分配や、分泌や吸収に関する物質を輸送する際のレールとして働く。
※3 CAMSAP3(カムサップスリー)
微小管の端(マイナス端と呼ばれる方)に結合するタンパク質。上皮細胞では、細胞の頂端面(※5参照)に局在し、微小管端をつなぎ止めている。その結果、上皮細胞内にすだれのような特徴的な微小管編成をつくりだしている。
※4 尿細管
腎臓は、糸球体と尿細管から成るネフロンと呼ばれる最小機能単位が多数集まってつくられている。尿細管は、糸球体で毛細血管から濾過された原尿が流れ込む管。糸球体に近い方から、近位尿細管、遠位尿細管、集合管領域に分けられる。集合管は膀胱へとつながっている。
※5 上皮細胞
多くの臓器(例えば、腸、腎臓、肺、肝臓など)や体の部位(例えば皮膚)を構成する主要な細胞群。上皮細胞は結合組織に裏打ちされ、結合組織に面した部分を基底面、反対側(腸や尿細管など、管を構成する上皮の場合は管腔側)を頂端面と呼ぶ。
※6 メカノセンサー
細胞にかかった力を感知して、細胞内に生体の反応を起こすシグナルを伝達するタンパク質。
※7 Camsap3ノックアウト(KO)マウス
Camsap3遺伝子を欠失させたマウス。KOマウスの作出では遺伝子の主要な領域のみ(遺伝子の一部)を欠失させることが多いが、Camsap3遺伝子の完全長KOマウスでは、ゲノム編集システムであるCRISPR/Cas9の手法を用いて、非常に長い領域にわたるCamsap3遺伝子の全長を欠失させた。
(8)論文情報
雑誌名:Scientific Reports
論文名:Cyst formation in proximal renal tubules caused by dysfunction of the microtubule minus-end regulator CAMSAP3
執筆者名(所属機関名):光畑有統1、阿部高也2、美崎佳寿代2、中島ゆうな1、桐谷啓太1、川崎美和2、清成寛2、竹市雅俊2、戸谷美夏2,3,4、佐藤政充 1,4,5
(1.早稲田大学 大学院先進理工学研究科 生命医科学専攻、2.理化学研究所 生命機能科学研究センター、3.早稲田大学 国際理工学センター、4.早稲田大学 先端生命動態研究所、5.早稲田大学 構造生物・創薬研究所)
掲載日:2021年3月12日(金)
DOI:https://doi.org/10.1038/s41598-021-85416-x
(9)研究助成
研究費名:文部科学省 科研費 基盤研究(C)
研究課題名:中心体に依存しない微小管の機能不全がひきおこす囊胞腎形成の分子機構
研究代表者名(所属機関名):戸谷 美夏(早稲田大学)







