慢性腎臓病により体内時計が乱れることを発見
発表のポイント
- 慢性腎臓病により体内時計の乱れが起き、結果として腎機能をさらに悪化させることを発見
- 生活習慣を整えることで体内時計の乱れを防ぎ、腎臓病悪化の予防に繋がる可能性がある
- 体内時計が乱れるメカニズムをさらに解明することで、新たな体内時計調節薬、腎臓病治療薬の開発につながることが期待される
早稲田大学理工学術院の田原優(たはらゆう)准教授および本橋弘章(もとはしひろあき、2018年3月卒業)、横浜市立大学医学部の涌井広道(わくいひろみち)講師、University of California Los AngelesのChristopher S. Colwell教授の研究グループは、慢性腎臓病モデルマウスを用い、慢性腎臓病により中枢や末梢臓器の体内時計の乱れが起き、それにより睡眠・覚醒パターンや血圧、腎機能の昼夜差が失われ、結果として腎機能をさらに悪化させることを発見しました。

図1 研究成果の概略図
本研究成果は、『Kidney International』に2020年1月13日午前9時(UTC、協定世界時)に掲載されました。
(1)これまでの研究でわかっていたこと
慢性腎臓病(chronic kidney disease: 以下、CKD)※1の患者数は年々増加しており、日本人のCKD患者数は約1330万人と推計され、成人約8人に1人はCKDであると言われています(日本腎臓学会『診療ガイドライン2018』※2)。また、腎機能は一度低下すると回復することは難しく、血液を濾過する透析のみが腎機能を維持する唯一の対処方法であり、CKDの発症予防、または悪化の予防がとても重要です。一方で腎臓病患者は、夜間の中途覚醒、睡眠の質低下、睡眠時間の減少、昼間の過度な眠気といった睡眠障害がしばしば見られ、体内時計(概日時計※3)の乱れが起きている可能性がありました。体内時計、つまり時計遺伝子は、腎臓でも24時間の時を刻んでおり、血液からの老廃物の濾過、尿の生成、血圧調節などを制御しています。しかし、CKDと時計遺伝子の関連、さらには睡眠障害との関連については明らかになっていませんでした。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
本研究では、アデニン誘発性の慢性腎臓病(CKD)モデルマウス※4を用いて、体内時計の変化や睡眠障害について解析を行いました。また、時計遺伝子の一つであるClock(クロック)の変異マウスを用いることで、体内時計の乱れが腎臓病の発症、進行に影響を与えるのかについて検討しました。
CKDモデルマウスでは、活動量の低下、睡眠の断片化(中途覚醒の増加)、飲水行動・尿の増加が見られました。中枢時計※5では、時計遺伝子Period2(ピリオド2)の発現の日内リズムが減弱していたことから、これらの睡眠・行動の変化は中枢時計の減弱によるものと考えられました。さらに、腎臓の時計遺伝子、時計制御下の遺伝子発現の日内リズムも減弱していました。CKD患者では高血圧が起こりますが、CKDモデルマウスでも高血圧、かつ低心拍数を示すと共に、睡眠時に血圧が低下しないnon-dipper型※6の変動を示しました。この結果は、CKD患者で多く見られるnon-dipper型高血圧を再現していると共に、本研究で見られた体内時計の乱れがnon-dipper型(日内リズムの消失)を引き起こしている可能性を示唆しています。
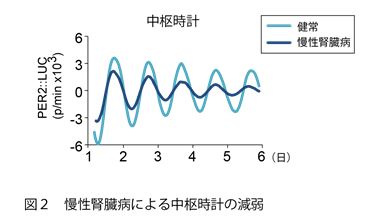
時計遺伝子Per2に生物発光を用いて可視化することで、培養した中枢時計を含む脳スライスから体内時計を測定した。健常マウスに比べ、慢性腎臓病モデルマウスの中枢時計では、約24時間周期の日々の振動現象は見られるものの、振幅が有意に低下していることが分かった。
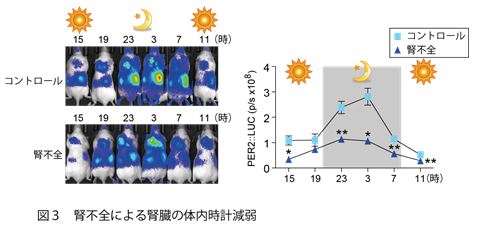
時計遺伝子Per2を生物発光を用いて可視化し、かつインビボ・イメージング手法を用いることで、腎臓の体内時計を非侵襲的に測定した。左図より、マウスの背中付近に左右2つの腎臓が見え、かつ夜に発光値が高い日内リズムを刻んでいることが分かる。コントロールに比べ、腎不全モデルマウスでは、発光値が有意に低下し、体内時計のメリハリが消失しているのが分かる(右図)。
次に、Clockの変異マウスを用いて、同様にアデニン誘発性の慢性腎臓病モデルマウスを作製しました。結果、通常のマウス(WT)で作成した慢性腎臓病モデルマウスに比べ、時計変異慢性腎臓病モデルマウスでは腎機能マーカーの悪化(尿中クレアチニン値低下、血清尿素窒素上昇など)、炎症・線維化マーカーの悪化がより見られました。特に時計変異慢性腎臓病モデルマウスにおいて、細胞外基質の分解酵素であるMMP-2/9(ゼラチナーゼ)の活性が高く、アデニン代謝物の腎臓内蓄積が多いことが悪化の原因と考えられました。

埋込み型センサを用いた心機能評価方法(テレメトリー)を用いて、それぞれの条件で血圧、心拍数の日内変動を測定した。WTマウス(通常のマウス)において、腎不全により、高血圧、低心拍数、かつ日内変動の消失(non-dipper型)が見られた。体内時計の乱れ(時計遺伝子Clockの変異マウス)では、通常飼育時に血圧、心拍数の立ち上がりの遅れが見られ、腎不全ではWTマウスに比べ、さらに高血圧、低心拍数を示した。
これらの結果をまとめると、慢性腎臓病により、中枢時計や末梢臓器の時計の乱れが起きることで、睡眠・覚醒パターンや血圧、腎機能の昼夜差が失われ、さらに乱れた体内時計は腎機能の悪化を促進するという負の連鎖が起きていることがわかりました。
(3)研究の波及効果や社会的影響
新たな国民病であるCKD患者は年々増加し、CKDから末期腎不全に至り透析療法を施行される患者数は33万人をこえ(日本透析医学会 2017年末『我が国の慢性透析療法の現況』※7)、医療経済的にも大きな問題となっています。よって、現在根本的な治療法が存在しない慢性腎臓病において、予防医学研究は重要です。
体内時計の乱れが腎臓病悪化の一因であるという本研究結果から、普段の生活習慣を規則正しく整え、体内時計の健康維持を目指すことが、腎臓病悪化の予防につながる可能性があります。一方、CKDは、腎不全の初期段階では目立った症状がなく、悪化するまで気がつかない病気です。そのため、普段から生活習慣を改めて体内時計を健康に保つことが、腎臓の悪化予防、ひいては健康寿命の延伸につながると考えられます。実際に、夜間勤務、シフトワーク等で生活習慣、体内時計が乱れている方は、腎機能が低下しているという疫学調査結果もあります。
(4)今後の課題
本研究では、慢性腎臓病そのものが体内時計を乱すという新たな発見がありました。今後、慢性腎臓病により体内時計が乱れるメカニズムについてさらに解明していくことで、新規の体内時計調節薬、腎臓病治療薬の開発につながる可能性があります。実際に慢性腎臓病の患者において、体内時計が乱れているのか、また生活習慣の改善が本当に腎機能に効果的かを調べる必要があります。
(5)用語説明
※1 慢性腎臓病
何らかの腎障害が3ヶ月以上続いた場合に慢性腎臓病と診断される。診断では、尿検査、血液検査、糸球体濾過量などを調べることで、腎機能を評価する。一般的に症状はなく、悪化するまで気がつかない。また、根本的な治療法はなく、食事改善、生活習慣改善などによる悪化の予防が重要である。末期の場合は、定期的な人工透析により血液の濾過を行う。慢性腎臓病の原因は様々で、肥満、高血圧、糖尿病、加齢、遺伝的要因などが考えられる。糖尿病性腎症は透析患者の中で最も割合の多い病気である。
※3 概日時計
睡眠・覚醒、体温、ホルモン分泌など、生体の様々な機能に見られる昼夜差、日内変動を制御するシステム。ClockやPeriod2といった時計遺伝子が細胞内で働くことで、約24時間の時を刻むことができる。体内時計の乱れは、睡眠障害、肥満、糖尿病、循環器系疾患、寿命の低下など様々な健康被害に繋がる。
※4 アデニン誘発性の慢性腎臓病モデルマウス
DNA、RNAを構成する塩基の一つであるアデニンを過剰投与することで(0.2%アデニン添加食をマウスに自由摂食)、生体内にアデニン代謝物が蓄積し、慢性的な腎不全症状を引き起こすモデル。同様のメカニズムで腎不全を示す疾患も存在する。アデニンホスホリボシルトランスフェラーゼ(APRT)の遺伝子異常による常染色体劣性遺伝疾患で、アデニン代謝物の蓄積により、尿路結石や腎不全を引き起こす。
※5 中枢時計
脳内の視床下部にある、視交叉上核と呼ばれる神経核に、中枢時計は存在する。中枢時計は全ての臓器にある”末梢時計”の時刻調節を行う司令塔である。中枢時計が機能しないマウスは、昼夜関わらず寝たり起きたりを繰り返し、生体リズムが消失する。
※6 non-dipper型
健常人では血圧は活動期に高く、夜間は10-20%低下する日内変動を示す。それに対し、夜間に血圧が低下しない(0-10%)場合をnon-dipper型と呼ぶ。non-dipper型の高血圧は、心血管イベントのリスクが高いことが報告されている。また、CKDの患者ではnon-dipper型の割合が特に多く、研究によっては高血圧者のうち8割はnon-dipper型を示したというデータもある。
※7 日本透析医学会 2017年末『我が国の慢性透析療法の現況』
(6)論文情報
雑誌名:Kidney International (国際腎臓学会の学術誌)
論文名:The circadian clock is disrupted in mice with adenine-induced tubulointerstitial nephropathy
執筆者名(所属機関名):Hiroaki Motohashi1,#, Yu Tahara1,2,#, Daniel S. Whittaker2, Huei-Bin Wang2, Takahiro Yamaji3, Hiromichi Wakui3, Atsushi Haraguchi1, Mayu Yamazaki1, Hiroki Miyakawa1, Koki Hama1, Hiroyuki Sasaki1, Tomoko Sakai1, Rina Hirooka1, Kengo Takahashi1, Miku Takizawa1, Saneyuki Makino1, Shinya Aoyama1, Christopher S. Colwell2, and Shigenobu Shibata1,*
(本橋 弘章1,#、田原 優1,2,#、Daniel S. Whittaker2、 Huei-Bin Wang2、山地 孝拡3、涌井 広道3、原口 敦嗣1、山崎 まゆ1、宮川 大輝1、濵 香樹1、佐々木 裕之1、酒井 智子1、廣岡 里菜1、高橋 健吾1、滝澤 美紅1、牧野 真之1、青山 晋也1、Christopher S. Colwell2、柴田 重信1,*)
執筆者所属先:
1:早稲田大学 理工学術院
2:University of California Los Angeles, Department of Psychiatry and Biobehavioral Sciences
3:横浜市立大学 医学部 循環器・腎臓・高血圧内科学教室
#筆頭著者、*責任著者
掲載日時(現地時間):2020年1月13日 午前9時(UTC、協定世界時)
掲載日時(日本時間):2020年1月13日 午後6時
DOI: https://doi.org/10.1016/j.kint.2019.09.032
(7)研究助成
研究費名:基盤研究(S)
研究課題名:時間栄養学を視点とした機能性食品成分の探索と応用研究
研究代表者名(所属機関名):柴田 重信(早稲田大学)
研究費名:SIP(戦略的イノベーション創造プログラム)「次世代農林水産業創造技術」
研究課題名:高齢者に配慮した時間栄養・運動に基づく次世代型食・運動レシピの開発
研究代表者名(所属機関名):柴田 重信(早稲田大学)