事故や病気による中枢神経系損傷からの組織再生を促す仕組み発見に期待
早稲田大学理工学術院の清水勇気(しみずゆうき)助手(同大学院先進理工学研究科博士後期課程3年)、上田悠人(うえだゆうと)(同大学院先進理工学研究科修士課程2年)および、大島登志男(おおしまとしお)教授(先進理工学研究科生命医科学専攻)の研究グループは、このたび、視蓋損傷によりラジアルグリアの細胞増殖が活性化し、新たに神経細胞が生み出されることを解明しました。事故や病気による中枢神経系損傷の課題を、神経組織再生の仕組みを探索していくことで、再生能力が低い哺乳類での神経再生能力向上の仕組み解明とその制御方法の開発が期待されます。
通常、視蓋(※注1)にはラジアルグリア(※注2)と呼ばれる神経幹細胞が存在していますが、通常時は増殖・分化をほとんど行っておらず、成体視蓋での機能はこれまで解明されていませんでした。本研究では、中枢神経系の再生機構を明らかにするために、視蓋と呼ばれる視覚情報を処理する領域に着目し、視蓋損傷モデルを作製することでラジアルグリアがどのような応答を示すのか検証しました。その結果、視蓋のラジアルグリアは損傷に応答し、増殖を活性化させ神経細胞を生み出す機能が明らかになりました。
発表のポイント
- 視蓋損傷によりラジアルグリアの細胞増殖が活性化し、新たに神経細胞が生み出されることを解明
- 視蓋にはラジアルグリアが存在しているが、通常、増殖・分化をほぼ行わず、機能は不明だった
- 再生能力が低い哺乳類での神経再生能力向上の仕組み解明とその制御方法の開発が期待
本研究成果は、米国Wiley Groupの科学誌『GLIA』に2018年2月7日付にてオンライン版で公開されました。
【研究内容に関するお問い合わせ先】
早稲田大学理工学術院 大島 登志男
TEL: 03-5369-7321 E-mail: [email protected]
(1)これまでの研究で分かっていたこと(科学史的・歴史的な背景など)
小型魚類のモデル生物であるゼブラフィッシュは高い組織再生能力を持つことが知られており、哺乳類では再生能力が乏しい中枢神経系が損傷しても、組織を元通りに再生することが可能です(参考文献1)。ゼブラフィッシュが持つ中枢神経系での高い再生能力は、神経幹細胞が活性化することで増殖し、新たな神経細胞を作り出すことで可能となっています。今回の研究のように、哺乳類での組織再生を促進するために、ゼブラフィッシュを用いた、再生時における神経幹細胞の増殖・分化を制御する分子機構が盛んに研究されています。また、ゼブラフィッシュはヒトやマウスに対して遺伝子の相同性(類似性)が高いことが明らかにされており、ゼブラフィッシュで得られた成果をヒトやマウスに応用することが十分に可能であると考えられています。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
今回、中枢神経系の再生機構を明らかにするために、視蓋と呼ばれる視覚情報を処理する領域に着目して研究を行いました。視蓋にはラジアルグリアと呼ばれる神経幹細胞が存在していますが、通常時は増殖・分化をほとんど行っておらず、成体視蓋での機能は明らかになっていませんでした(参考文献2)。そこで、私たちの研究グループは視蓋損傷モデルを作製し、ラジアルグリアがどのような応答を示すのか検証することにしました。今回の研究で、視蓋損傷によりラジアルグリアの細胞増殖が活性化し、新たに神経細胞が生み出されることが明らかとなりました。また、これらの応答を制御する分子メカニズムにWntシグナル(※注3)の活性化が必要であることが、遺伝子組換えゼブラフィッシュや薬剤を用いた解析により明らかとなりました。
(3)そのために新しく開発した手法
これまでに、ゼブラフィッシュの視蓋を用いた損傷モデルは報告されていなかった為、新しい穿刺損傷のモデルとして視蓋損傷モデルを作製しました。損傷の深さや場所を検討し、損傷後のラジアルグリアの応答が再現性高く確認できる損傷方法を確立しました。
(4)今回の研究で得られた結果及び知見
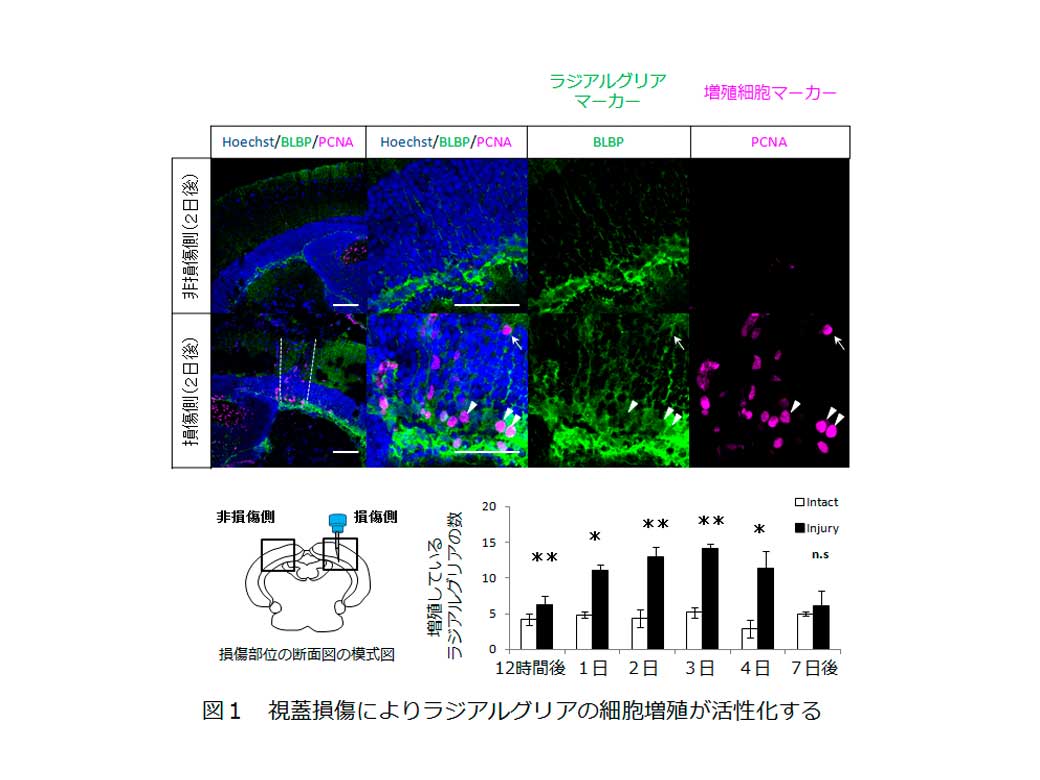
まず、ゼブラフィッシュの成体(3ヶ月齢)の視蓋では大部分のラジアルグリアは増殖していないことが増殖している細胞数のカウントにより明らかとなりました。次に、視蓋損傷モデルを作製し、神経幹細胞の細胞増殖や神経細胞の分化などを解析しました。ラジアルグリアの細胞増殖を調べるために、ラジアルグリアのマーカー(BLBP)と増殖細胞のマーカー(PCNA)を用いて組織の染色を行い、二重陽性の細胞を増殖しているラジアルグリアとしてカウントしました。ラジアルグリアは損傷に応答し、損傷後3日前後をピークに細胞増殖を活性化させ、損傷7日後には非損傷状態と同じ程度に戻ることが明らかになりました(図1)。
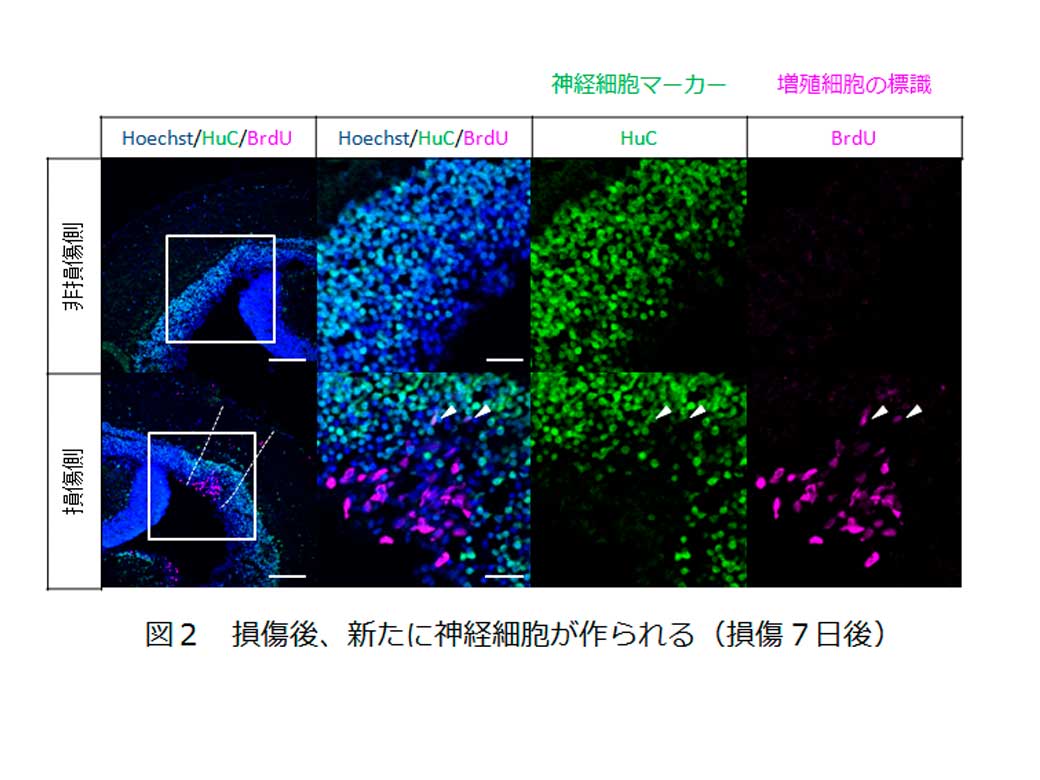
さらに、損傷により失われた神経組織を補うために新しい神経細胞がラジアルグリアから作り出されていることを調べるために、損傷2日から3日後の間に増殖細胞を標識(BrdU標識)し、損傷7日後において標識された細胞が神経細胞マーカー(HuC)を発現するかどうか確認しました。その結果、損傷側において新たに産み出された神経細胞(BrdUとHuCの二重陽性な細胞)が増えていることがわかりました。(図2)。
このことから、視蓋のラジアルグリアは損傷に応答し、増殖を活性化させ神経細胞を生み出す機能があることが示唆されました。
次に、ラジアルグリアの増殖・分化を制御する分子メカニズムとしてWntシグナルに着目し解析を行いました。Wntシグナルの活性化を可視化する遺伝子組換えゼブラフィッシュを用いて損傷実験を行った結果、ラジアルグリアにおいてWntシグナルが活性化していることが明らかとなりました(図3)。

また、Wntシグナルの活性を制御する薬剤投与の実験を行い、Wntシグナル抑制がラジアルグリアの増殖・分化に与える影響を調べました。まず、増殖への影響を調べるために損傷後2日間、Wntシグナル阻害剤を投与し増殖しているラジアルグリアの数をカウントした結果、Wntシグナル抑制がラジアルグリアの増殖を抑制することが明らかになりました(図4)。
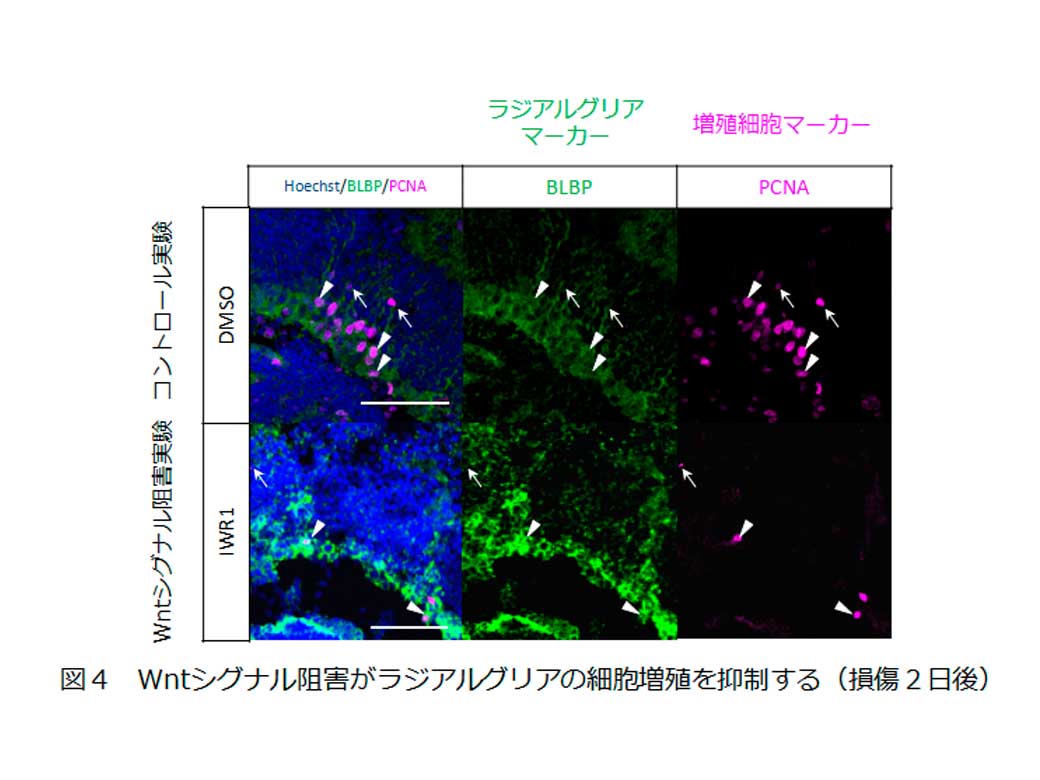
次に、分化への影響を調べるために損傷後2日間で増殖細胞を標識したのちWntシグナル阻害剤を投与し新たに産み出された神経細胞をカウントした結果、Wntシグナル抑制が神経細胞の産生を抑制することが明らかになりました(図5)。
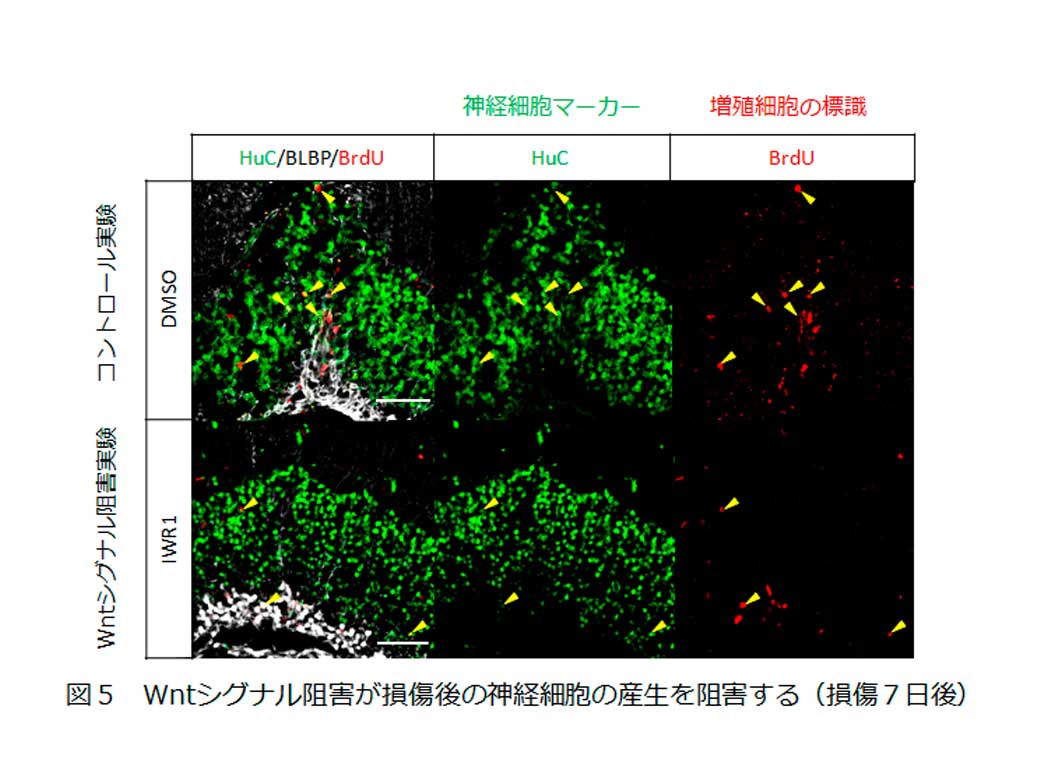
これらのことから、損傷後のWntシグナルの活性化がラジアルグリアの増殖および神経細胞の産生に必要であることが明らかとなりました。
(5)研究の波及効果や社会的影響
今回の研究により、視蓋での組織再生機構の一端が明らかとなりました。ゼブラフィッシュでは多様な神経損傷モデルが作製されており、神経幹細胞の増殖・分化を制御する分子機構が盛んに研究されています。様々なモデルにおいて神経幹細胞の制御機構を解析し、モデル間で比較検討することで、ゼブラフィッシュが持つ高い再生能力を制御する仕組みが明らかにされることが期待されます。
事故や病気による中枢神経系の損傷は生活の質を著しく低下させることが問題となっています。今後は、再生能力が低いマウスでの神経幹細胞の応答と再生能力が高いゼブラフィッシュでの神経幹細胞の応答の違いを遺伝子レベルで網羅的に解析することで、哺乳類での神経組織再生を促す仕組みが発見されることが期待されます。
(6)今後の課題
今回の研究では損傷後に新しく作られた神経細胞の種類や機能は明らかにされていません。ラジアルグリアから作られる細胞を標識する遺伝子組換えゼブラフィッシュを用いることで、新しく作られた神経細胞が神経組織の機能回復に貢献していることを調べる必要があります。
また、ゼブラフィッシュの再生能力を制御する仕組みがマウスでも機能することが明らかにされつつありますが、現状ではその効果は限定的なものであることが報告されています。マウスとゼブラフィッシュにおける再生能力を制御する仕組みの違いをより詳細に探索していくことで、哺乳類の再生能力を向上させる仕組みを解明および制御方法の開発が今後の課題となっています。
(7)100字程度の概要
ゼブラフィッシュを用いた新たな脳損傷モデルを作製し、中枢神経系の組織再生の一端を明らかにした。損傷後、神経幹細胞でWntシグナルが活性化し、増殖および神経細胞への分化が誘導されることが明らかとなった。
【用語説明】
- 注1:視蓋 – 中脳に位置し、視覚情報を処理する脳部位。
- 注2:ラジアルグリア – 神経細胞やグリア細胞を生み出す神経幹細胞の1つ。
- 注3:Wntシグナル – 細胞の増殖や分化に関わるシグナル。生物種を超えて広く保存されている。
【参考文献】
- Kroehne et al., Development, 2011. DOI: 10.1242/dev.072587
- Ito et al., Developmental Biology, 2010. DOI: 10.1016/j.ydbio.2010.03.008