神経細胞死を抑制している可能性を示唆
早稲田大学ナノ・ライフ創新研究機構の澤村直哉(さわむらなおや)研究院准教授と、同大学院修了・藤原美紅(ふじわらみく)氏、同大学院修了・山田春佳(やまだはるか)氏、同理工学術院の朝日透(あさひとおる)教授、東京薬科大学薬学部の山田まりこ(やまだまりこ)大学院生、林秀樹(はやしひでき)講師、高木教夫(たかぎのりお)教授らの研究グループは、このたび、サリドマイドの脳梗塞に対する薬効メカニズムの一つとして、サリドマイドのターゲットタンパク質であるセレブロン(CRBN)を介して生体内のエネルギーセンサー(AMPK)の活性を調節し、神経細胞死を抑制している可能性を明らかにしました。
脳梗塞は、脳血管の狭窄や閉塞により脳における酸素及びエネルギーが欠乏状態になり、脳細胞が障害を受けることにより、脳神経細胞死が引き起こされる疾患です。サリドマイドは過去に妊婦が服用すると胎児に奇形が生じるということで販売が中止された薬剤ですが、近年、脳神経疾患への効果として、脳虚血モデルでの神経細胞死に対して保護効果を持つことが報告されていました。しかし、その詳細な分子メカニズムについては解明されていませんでした。
本研究では、サリドマイドの脳梗塞への有効性と細胞内シグナルを調べるために、ヒト脳梗塞の模倣モデルとして用いられるラット中大脳動脈閉塞/再灌流モデルを作製して解析を行いました。この結果、サリドマイドはその標的分子であるCRBNを介してAMPK-CRBNの相互作用を変化させることでAMPKの活性を調節し、脳虚血による神経細胞死を抑制している可能性があることを明らかにしました。今後、より安全で安定なサリドマイド誘導体や、AMPK-CRBNの結合を強めるような薬剤を開発することにより、脳梗塞に有効な薬剤の開発に繋がることが期待できます。
発表のポイント
- サリドマイドが脳梗塞モデルに有効であることを確認しました。
- サリドマイドによる神経保護効果に関与する細胞内シグナルを同定しました。
- サリドマイドの神経保護効果に関する詳細な分子メカニズムが明らかになりました。
本研究成果は、2018年2月6日付の英国Nature Publishing Groupのオンライン科学雑誌『Scientific Reports』に掲載されます。本研究の一部は早稲田大学がサテライトとして展開している科学技術振興機構(JST)が推進するセンター・オブ・イノベーション(COI)プログラムの「さりげないセンシングと日常人間ドックで実現する理想自己と家族の絆が導くモチベーション向上社会創生拠点」で得られた研究成果です。
(1) これまでの研究で分かっていたこと(科学史的・歴史的な背景など)
脳梗塞は、脳血管の狭窄や閉塞により脳における酸素及びエネルギーが欠乏状態になり、脳細胞が障害を受けることにより、脳神経細胞死が引き起こされる疾患です。主症状としては、脳の片半球に梗塞ができることで、その半球の支配領域である反対側半身の運動機能が障害される片麻痺が起こり、深刻な後遺症が残ることも多い疾患です。脳梗塞は、世界中で主要な死因であるとともに様々な重度の障害をもたらすため、有効な治療法の発見が大きく期待されています。
サリドマイドは過去に妊婦が服用すると胎児に奇形が生じるということで販売が中止された薬剤ですが、近年、その誘導体であるポマリドミドやレナリドミドとともにハンセン病や多発性骨髄腫に対する治療薬として脚光を浴び、条件付きでの使用が再承認されてきています。また、サリドマイドは、脳神経疾患への効果として、脳虚血モデルでの神経細胞死に対して保護効果を持つことが報告されていました [1,2]。しかし、その詳細な分子メカニズムについては解明されていませんでした。
これまで、サリドマイドとの結合タンパクとして、精神遅滞原因遺伝子産物でもあるセレブロン(Cereblon; CRBN)が同定されていました [3]。我々は先行研究において、ストレス応答分子としてのCRBNの機能に着目し、CRBNがプロテアソーム阻害によりアグリソームに蓄積し、細胞死に対する抑制効果を持つ事を明らかにしました [4]。さらに、セレブロンをミトコンドリアに特異的に発現させる事で、セレブロンが抗酸化ストレス・細胞保護機能を持っている事を明らかにしてきました [5]。一方、CRBNに直接的に結合するタンパク質として、AMP活性化プロテインキナーゼ(AMP-activated protein kinase; AMPK)が同定されていました [6]。AMPKは、細胞内のエネルギー源であるアデノシン三リン酸(Adenosine triphosphate; ATP)が枯渇すると活性化(リン酸化)することで、細胞内ATP量の恒常性を維持する重要なエネルギーセンサーであり、脳虚血下でリン酸化増幅が起きているという報告があり、AMPKの脱リン酸化が神経保護につながると考えられていました [7, 8]。
(2) 今回の研究で新たに実現しようとしたこと、明らかになったこと
本研究では、サリドマイドの脳梗塞に対する神経保護効果の分子メカニズムについて、サリドマイドの標的タンパクであるCRBNと、その結合タンパクAMPKの活性調節に着目して検討を行いました。この結果、サリドマイドはその標的分子であるCRBNを介してAMPK-CRBNの相互作用を変化させることでAMPKの活性を調節し、脳虚血による神経細胞死を抑制している可能性があることが明らかになりました。
(3) そのために新しく開発した手法
本研究では、サリドマイドの脳梗塞への有効性と細胞内シグナルを調べるために、ヒト脳梗塞の模倣モデルとして用いられるラット中大脳動脈閉塞/再灌流モデルを作製して解析を行いました。脳梗塞を引き起こす血栓形成の約80%が中大脳動脈で起こる事が知られています。このモデルではラットの中大脳動脈を閉塞すること(=中大脳動脈閉塞/再灌流術:Middle Cerebral Artery Occlusion / Reperfusion; MCAO/R)により、閉塞側の脳に対し、中大脳動脈支配領域である線条体と大脳皮質に梗塞巣を作製することができます。このモデルラットの腹腔内にサリドマイドを投与することで、脳梗塞への有効性と関連するシグナルの解析を行いました。また、サリドマイドによる神経細胞死抑制の詳細な分子メカニズムを調べるために、過酸化水素を神経芽細胞腫であるSH-SY5Yに添加して酸化ストレスを与え、脳虚血モデル細胞として使用しました。
(4) 今回の研究で得られた結果及び知見
本研究ではラットにMCAO/Rを行い、脳梗塞モデルを作製しました。MCAO/R処理の際にサリドマイドを腹腔内投与しておくと梗塞領域の減少が見られ、神経欠損症状も軽減したことから、脳虚血にサリドマイドが有効であることが確認されました(図1)
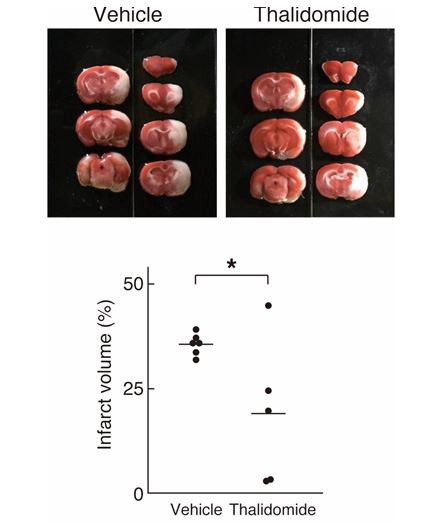
図1. 脳虚血モデルラットの梗塞巣の定量
※TTC染色画像の非染色部位すなわち梗塞領域を定量した。MCAO/Rにより生じた梗塞領域の総体積を算出した結果、MCAO/Rにより生じた梗塞巣がサリドマイド投与により有意に減少することが確認された(*p<0.05)。Scientific Reports 8, Article number: 2459, Figure No. 1bc, 6 February 2018 © Macmillan Publishers Limited.
次に神経保護効果に関与する細胞内シグナルの探索を行いました。神経保護に働くシグナルであるAMPK、ERK1/2、AKTについて、脳虚血及びサリドマイド投与によりどのような変化があるのかを調べた結果、AMPKのリン酸化のみ、サリドマイド投与により抑制されることが分かりました(図2)。
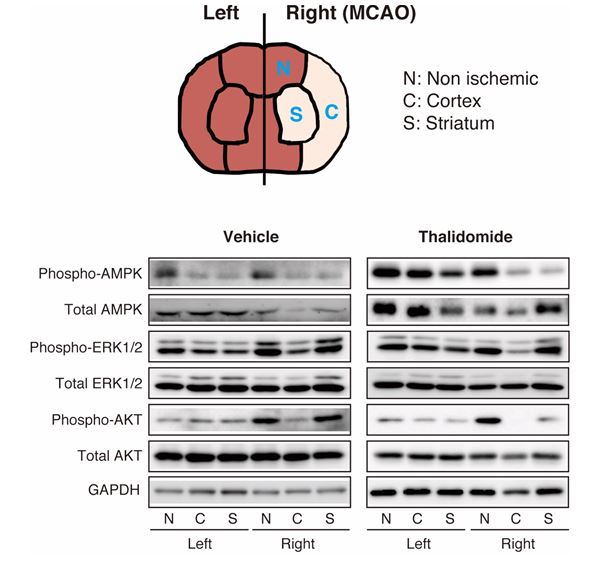
図2. 脳虚血モデルラットにおける神経保護シグナルの検出
※神経保護に働くシグナルであるAMPK、ERK1/2、AKTのうち、AMPKに関してのみ、サリドマイド(Thalidomide)投与ラットの大脳皮質梗塞領域 (C) 及び線条体 (S) について、左半球 (Left) と右半球 (Right) を比較するとリン酸化が抑制されていた。Scientific Reports 8, Article number: 2459, Figure No. 3ab, 6 February 2018. © Macmillan Publishers Limited.
さらに、サリドマイドによる神経保護作用が起こる際にAMPK-CRBN相互作用が変化しているのではないかと考え、脳虚血モデル細胞での検証を行いました。SH-SY5Y細胞に酸化ストレスを加えた際、またそれと同時にサリドマイドを投与した際のAMPKとCRBNの相互作用を免疫沈降法により検証した結果、通常のSH-SY5Y細胞においてAMPKとCRBNは強く結合していましたが、過酸化水素添加によりAMPKとCRBNの結合が弱まっていました。しかし過酸化水素と同時にサリドマイドを投与するとAMPKとCRBNの結合が回復しました(図3)。
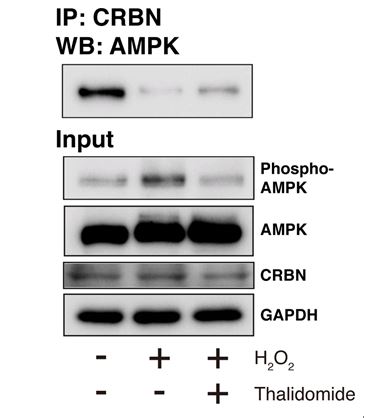
図3. 脳虚血モデル細胞へのサリドマイド投与によるAMPKとCRBNの相互作用の変化
※過酸化水素を投与した脳虚血モデル細胞でAMPKのリン酸化増幅が確認された。しかし、サリドマイドを同時に投与すると、AMPKのリン酸化増幅が抑制された。またAMPK-CRBN相互作用については、過酸化水素の投与によりAMPK-CRBNの結合が弱まることが分かった。しかし、サリドマイドを同時に投与すると、AMPK-CRBNの結合が回復した。Scientific Reports 8, Article number: 2459, Figure No. 4c, 6 February 2018. © Macmillan Publishers Limited.
以上の結果から、酸化ストレス下でサリドマイドがCRBNを介してAMPKの活性を調節し、神経細胞死を抑制することが示唆されました。
(5) 研究の波及効果や社会的影響
サリドマイドの脳梗塞に対する薬効のメカニズムの一つとして、サリドマイドのターゲットタンパク質であるCRBNを介してエネルギーセンサーであるAMPKの活性を調節し、神経細胞死を抑制している可能性が示唆されました。今後、より安全で安定なサリドマイド誘導体や、AMPK-CRBNの結合を強めるような薬剤を開発することにより、脳梗塞に有効な薬剤の開発に繋がることが期待されます。
(6) 今後の課題
サリドマイドは水溶液中において自発的かつ速やかに加水分解を受けるため不安定な薬剤でもあります。今後は、サリドマイドの誘導体であり、構造が安定な代謝産物やサリドマイドの加水分解産物を用いて、より神経保護効果が大きく副作用が少ないものを同定する必要があります。
また、我々はストレス応答分子としてのCRBNの機能に着目して研究を進めています。本研究では急性のストレスである脳梗塞モデルへのサリドマイド投与により、ストレス応答分子としてのCRBNの働きが強くなって細胞死の抑制が起こっているのではないかと考えています。ストレス応答分子としてのCRBNに着目し、CRBNの機能低下がストレスや老化の指標(バイオマーカー)になるのではないかと考え、老化・ストレスモデルでのセレブロンの応答に着目して研究を進めています。
(7) 100字程度の概要
サリドマイドの脳梗塞に対する薬効のメカニズムの一つとして、サリドマイドのターゲットタンパク質であるセレブロンを介して生体内のエネルギーセンサーであるAMPKの活性を調節し、神経細胞死を抑制している可能性が示唆されました。
用語説明
- AMPK – AMP活性化プロテインキナーゼ(AMP-activated protein kinase; AMPK)。細胞内のエネルギー源であるアデノシン三リン酸(Adenosine triphosphate; ATP)が枯渇すると活性化(リン酸化)することで、細胞内ATP量の恒常性を維持する重要なエネルギーセンサー。
- ATP – アデノシン三リン酸(Adenosine triphosphate; ATP)。生体内のエネルギー源として使われている分子。
- SH-SY5Y – ヒト由来の神経芽細胞腫。神経細胞のモデルの培養細胞として広く使われている。
- ERK1/2 – Extracellular signal-regulated kinase 1/2。細胞外の様々な刺激に応答するリン酸化酵素の一つである。神経保護効果に関与する細胞内シグナルの一つとして知られている。
- AKT – 細胞外の様々な刺激に応答するリン酸化酵素の一つである。神経保護効果に関与する細胞内シグナルの一つとして知られている。
参考文献
- Hyakkoku et al. Neuroscience 159, 760–769 (2009)
- Palencia et al. J Neurol Sci 351, 78–87 (2015)
- Ito et al. Science 327, 1345-1350 (2010)
- Sawamura et al. BBRC 464, 1054-1059 (2015)
- Kataoka et al. Scientific reports 6, 29986 (2016)
- Lee et al. Biochimica et biophysica acta 1813, 448–455 (2011)
- McCullough et al. Journal of biological chemistry 280, 20493–20502 (2005)
- Li et al. Stroke 38, 2992–2999 (2007)
論文情報
- 掲載誌:Scientific Reports 8, Article number: 2459 (2018)
- 論文名:The Neuroprotective Effect of Thalidomide against Ischemia through the Cereblon -mediated Repression of AMPK Activity
- 著 者:澤村直哉(早稲田大), 山田まりこ(東京薬科大), 藤原美紅(早稲田大), 山田春佳(早稲田大), 林秀樹(東京薬科大), 高木教夫(東京薬科大), 朝日透(早稲田大)
- DOI: 10.1038/s41598-018-20911-2
研究内容に関するお問い合わせ先
早稲田大学ナノ・ライフ創新研究機構 澤村 直哉
TEL: 03-5369-7327 E-mail: [email protected]