世界初・人工細胞で「細胞質流動」の再現に成功
機械よりも高効率で働く生体機能を模倣した輸送システム構築の可能性
早稲田大学理工学術院の鈴木和也(すずきかずや)助手、宮﨑牧人(みやざきまきと)助教、石渡信一(いしわたしんいち)名誉教授らの研究グループは、人工的な環境下で微小管による「細胞質流動」の再現に世界で初めて成功し、流動の発生における細胞膜や微小管の剛性の役割を明らかにしました。
細胞質流動とは、「細胞質と呼ばれる細胞を満たしている液体が細胞内で流れる現象」で、細胞全体に栄養素を行き渡らせるための物質輸送システムであると考えられています。流動を引き起こす線維状タンパク質にはアクチン線維と微小管の2種類があり、微小管が引き起こす流動は未解明な部分が多く残されていました。例えばウニの卵やショウジョウバエの卵母細胞で生じる微小管駆動の流動では、微小管が渦状に配列したネットワーク構造が形成され、この配列に沿った回転流動が生じることが特徴ですが、そもそもどのようにしてこのような渦構造が形成されるのか明らかになっておらず、従来の細胞質流動の研究では、細胞膜や微小管の力学的性質はほとんど考慮されていませんでした。
細胞質流動の仕組みを解明するために、今回の研究で特に着目したのが、細胞膜の物理的な“壁”としての役割です。棒の片端を持って、もう一方の端を壁に押し当てれば、棒は曲がったり、傾いたりします。本研究グループは、このようなことが微小管と細胞膜との間でも起こり、渦構造の形成と回転流動の発生に寄与していることを明らかにしました。本研究の成果は細胞質流動の研究に新たな視点を与え、その仕組みを解き明かす手がかりとなることが期待されます。
生体システムは、人間が設計した機械よりも非常に高いエネルギー効率で機能することが知られています。そのため、生体機能を模倣したシステムの構築を目指した研究が盛んに行われています。本研究の成果は、生物学、医療分野はもちろん、生体工学分野への貢献として、生体機能を模倣した輸送システム構築の可能性が開けることも大きく期待できます。
本研究成果は、米国科学アカデミー紀要(PNAS)のオンライン版に2017年3月6日午後3時(日本時間3月7日午前5時)に掲載されました。
(1)これまでの研究で分かっていたこと

図1:細胞における微小管渦構造と、細胞質流動の模式図
細胞質流動とは、一般に「細胞質と呼ばれる細胞を満たしている液体が細胞内で流れる現象」で、原形質流動やアメーバ運動など、生物の教科書でおなじみの現象も含まれます。細胞質流動は200年以上前に植物細胞で発見された現象で、その後、動物の受精卵などでも発見が相次ぎましたが、その役割は長らく不明でした。しかしながら近年、小胞など、細胞の構成要素としては比較的大きい構造物の輸送に細胞質流動が利用されていることが示されました。多くの小胞が栄養素を含んでいることや、細胞質流動が発生過程(受精卵が分裂を繰り返し、成体になるまでの過程)、そして細胞の成長に重要であることから、現在では、細胞質流動は細胞全体に栄養素を行き渡らせるための物質輸送システムであると考えられています。そのため、生物学、医学的な見地からの研究が盛んに行われています。また、最近ではアクティブ流体(自律的に流れを生み出す流体の総称)の研究対象としても扱われ始めており、物理学や工学の分野でも関心を集めている現象です。
細胞質流動は、流動を引き起こす線維状タンパク質によって、2種類に分類できます。1つがアクチン線維、もう1つが微小管です。アクチン線維が引き起こす流動と比較して、微小管が引き起こす流動は未解明な部分が多く残されています。例えばウニの卵やショウジョウバエの卵母細胞で生じる微小管駆動の流動では、微小管が渦状に配列したネットワーク構造が形成され、この配列に沿った回転流動が生じることが特徴ですが(図1)、そもそもどのようにして渦構造が形成されるのか、明らかになっていませんでした。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
私たちは、微小管が渦構造を形成し、細胞質流動を引き起こす仕組みを明らかにしようと考えました。その中で着目したのが、細胞膜の物理的な“壁”としての役割です。棒の片端を持って、もう一方の端を壁に押し当てれば、棒は曲がったり、傾いたりします。私たちは、こういったことが微小管と細胞膜との間でも起こり、ネットワーク構造の形成に影響するのではと予想しました。壁の影響を調べるためには、微小管にとって狭い空間(広がりが1 mm以下の空間)と、壁がないとみなせるほど広い空間で形成されるネットワーク構造や流動の様子を観察し、それらを比較する必要があります。これは細胞の大きさを変化させることで可能となりますが、細胞の生化学的特性を変えずに、大きさのみを変えることは非常に困難です。そこで私たちは、大きさを自在に制御できる人工細胞システムを構築し、回転流動が観察されている細胞と同程度の大きさの人工細胞内で、微小管渦構造の形成と回転流動が生じることを発見しました。
(3)そのために新しく開発した手法
私たちはアフリカツメガエルの卵から細胞質を抽出し、細胞を模したカプセル(油中液滴)に封入することで、人工細胞系を構築しました(図2)。この手法は、以前私たちが開発した方法(Miyazaki M. et al., Nat. Cell Biol. 2015)の応用です。この実験系は、人工細胞の大きさを自在に制御できることが最大の特徴ですが、大きさとは独立に人工細胞内の各種タンパク質の活性も自在に制御することが可能です。これらの利点を活用することで、渦構造形成における細胞膜の壁としての役割と、細胞質流動の駆動力を定量的に調べることが初めて可能になりました。

図2:人工細胞系の(左)模式図と(右)顕微鏡写真。顕微鏡写真から、様々な大きさの人工細胞が一度にたくさん形成されることがわかる。細胞膜の主要構成要素であるリン脂質でカプセル表面を覆い、細胞内環境を模倣した。スケールバーは100 μm
(4)今回の研究で得られた結果及び知見
細胞内ではキネシンやダイニンと呼ばれる分子モーターが微小管どうしを架橋し、微小管の滑り運動を駆動することが知られています。細胞を用いたこれまでの研究で、ダイニンの機能の抑制が細胞質流動の引き金になっていることが示唆されていました。そこで私たちは、人為的にダイニンの機能を抑制した細胞質抽出液を用いて、細胞膜の“壁”としての効果を調べました。まず、細胞質抽出液をカプセルに封入しないで観察した場合、微小管どうしが束になり、さらにその束どうしがランダムに架橋された、無秩序な網目状構造が形成され(図3A)、細胞質全域で乱流のような複雑な流れが生じました(図3B)。一方で、細胞質抽出液をカプセル(直径100‒700 μm)に封入したところ、微小管の束が自発的に渦状に配列し(図4A)、カプセル内全域の細胞質が一方向に回る大域的な流れが発生しました(図4B)。この流れは、数十分から数時間にわたって持続する安定的な流動でした。
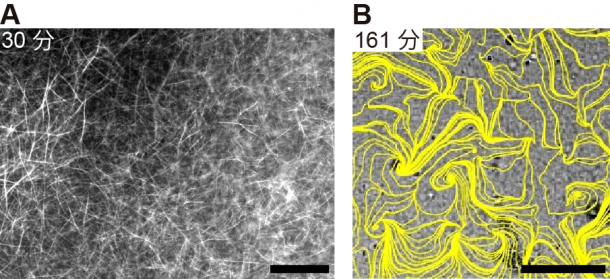
図3:十分広い空間における(A)微小管構造と(B)細胞質流動の流線。(A)と(B)は別サンプルの顕微鏡写真。微小管の重合を開始させた時刻を0分とした。右下のスケールバーは、(A)、(B)ともに100 μm

図4:液滴内における(A)微小管渦構造形成の過程と、(B)細胞質流動の様子。全ての画像において、点線は液滴境界を表す。(A)と(B)は、別の液滴であり、(B)は、細胞質に混ぜておいた微小ビーズの軌跡を示している。微小管の重合を開始させた時刻を0分とした。スケールバーは、(A)、(B)ともに30 μm
さらに私たちは、個々の微小管束の動態、カプセルの大きさと流速の関係、キネシンの機能の抑制効果などを調べることで、渦構造の形成と回転流動のメカニズムを明らかにしました。そのメカニズムは以下の通りです。まず、様々な箇所で微小管束が形成され、キネシンによって微小管束が伸びていきつつ束どうしが架橋されることで、網目状構造が形成されます。微小管束がさらに伸びて片端が液滴境界にぶつかると、“壁”を押す力を出すようになります。微小管束は、最初は様々な方向を向いているため、境界で発生する力の方向も様々であり、それらの間で力のつり合いが生まれますが、右回転と左回転の力のつり合いが崩れたとき、網目状構造全体が右、あるいは左にゆっくりと回転し始めます。構造の回転によって生じた流れにより、回転方向に傾く微小管束が増加し、らせん状に配列します。らせん状に配列した微小管束が境界を押す力が、さらに構造全体の回転を促進し、回転流動が加速されます。つまり、細胞質の流れと微小管配向の間の正のフィードバック作用によって、長時間持続する大域的な回転流動が発生したと考えられます。
一般的に、棒で物体を押して動かす、あるいは棒が傾くには、棒そのものが硬くなければなりません。このような物理学的事実から、渦構造の回転には、微小管そのものの剛性が重要であると考えられます。したがって私たちの結果は、実際の細胞が、細胞膜の物理的な壁としての機能と、微小管の剛性を活用することで、長時間持続する大規模な流動を引き起こしていることを示唆しています。
(5)研究の波及効果や社会的影響
私たちは、人工的な環境下で微小管による細胞質流動の再現に世界で初めて成功し、流動の発生における細胞膜や微小管の剛性の役割を明らかにしました。細胞膜や微小管の力学的性質は従来の細胞質流動の研究においてはほとんど考慮されていませんでした。したがって、本研究の成果は細胞質流動の研究に新たな視点を与え、その仕組みを解き明かす手がかりとなることが期待されます。
生体システムは、人間が設計した機械よりも非常に高いエネルギー効率で機能することが知られています。そのため、生体機能を模倣したシステムの構築を目指した研究が盛んに行われています。そのため、本研究の成果は、生物学、医療分野はもちろん、生体工学分野への貢献として、生体機能を模倣した輸送システム構築の可能性が開けることも大きく期待できます。
(6)今後の課題
私たちが再現に成功した細胞質流動は、実際の細胞と同程度の大きさの液滴の中でのみ発生しました。生物学における古典的な問題として、どのようにして細胞の大きさは決まっているのか、そして細胞の大きさの生物学的意義とは何か、という問題があります。細胞質流動の大きさ依存性をさらに詳細に解析していくことで、このような問題を解決する糸口をつかむことができるかもしれません。
また、冒頭で述べたように、本研究で着目した微小管以外に、アクチン線維による細胞質流動も多くの動物種、植物種の細胞で観察されています。アクチン駆動の流動においても、アクチン線維の剛性や細胞の大きさといった力学的な性質が流動の発生に関与していると考えられていますが、未だ明らかになっていません。本研究で構築した手法を基に、アクチン駆動の流動を再現する人工細胞系を開発することで、実際の細胞を用いた研究ではアプローチが困難な問題の解明に取り組んで行くことが、今後の課題です。
(7)100字程度の概要
微小管による細胞質流動を人工細胞系で再現することに、世界に先駆けて成功した。流動の発生や維持において、細胞膜の物理的な壁としての役割と、微小管の剛性が重要であることを示した。
論文情報
- 掲載雑誌:米国科学アカデミー紀要(PNAS)
- 論文名:Spatial confinement of active microtubule networks induces large-scale rotational cytoplasmic flow
- 著者: Kazuya Suzuki, Makito Miyazaki(corresponding author), Jun Takagi, Takeshi Itabashi, Shin’ichi Ishiwata(鈴木和也(早稲田大学理工学術院助手・早稲田大学バイオサイエンスシンガポール研究所員)、宮﨑牧人(早稲田大学理工学術院助教・早稲田大学バイオサイエンスシンガポール研究所員)、高木潤(早稲田大学理工学術院助手(現 国立遺伝学研究所博士研究員))、板橋岳志(早稲田大学理工学術院助教・早稲田大学バイオサイエンスシンガポール研究所員)、石渡信一(早稲田大学理工学術院名誉教授))
- DOI: 10.1073/pnas.1616001114







