早稲田大学理工学術院総合研究所の塩田邦郎上級研究員(研究院教授)と新井大祐次席研究員(研究院講師)らの研究グループは、東京大学、理化学研究所と共同で、糖(N-アセチルグルコサミン)による新たなヒストン化学修飾を発見しました。今回の研究成果は、英国Nature Publishing Groupのオンライン科学雑誌『Scientific Reports』に、日本時間9月12日午後6時(現地時間:9月12日午前10時)に掲載されました。
ポイント
- 進化の上で胎生動物出現の鍵となる新規のエピジェネティック修飾(注1)を発見しました。
- 発見した新たなヒストン糖修飾(注2)は、胎生動物に特有である。ヒストン糖修飾の有無により生じるヌクレオソーム(注3)の多様性が、遺伝子制御をさらに複雑にします。
- 発見されたエピジェネティック修飾は、胎生動物特有の発生機構あるいは病気の原因の解明に新たな視点を提供できます。
発表概要
ゲノムDNAはヒストンタンパク質に巻き付いて、ヌクレオソーム構造をとっている。この構造は、遺伝子がいかに使われるかに影響する。東京大学大学院農学生命科学研究科の廣澤瑞子助教、早川晃司特任助教、田中智准教授らの研究グループは、早稲田大学、理化学研究所と共同で、糖(N-アセチルグルコサミン)による新たなヒストン化学修飾を発見した。この糖修飾は一般的に栄養応答性があることが知られ、ヌクレオソーム構造に強く関与する部位に存在していた。ヒストンには多くのアイソフォーム(注4)が存在するが、互いに極めて相同性が高く、数個のアミノ酸の違いがあるのみで、これまでは同一視されてきた。しかし、発見された新たな糖修飾は、胎生動物に特徴的なヒストンアイソフォームにのみ付加できるため、アイソフォームには個性があることが示された。生物進化の過程における多様性の実現は、遺伝子数の増加だけでは説明が難しい。胎生動物が出現した時期に、わずか一つのアミノ酸の変異がおこって、ヒストンの糖修飾が可能になった。それによって生じたヌクレオソームの多様性が遺伝子利用の多様性に繋がったと考えると、エピジェネティックな進化が胎生動物の出現に寄与したことが想起される(図1)。この糖修飾を特異的に認識する単クローナル抗体は、生物学的機能解明への強力なツールとなり、特に、哺乳類に特有な病気の原因解明あるいは治療開発に、栄養学的観点から威力を発揮することが期待できる。
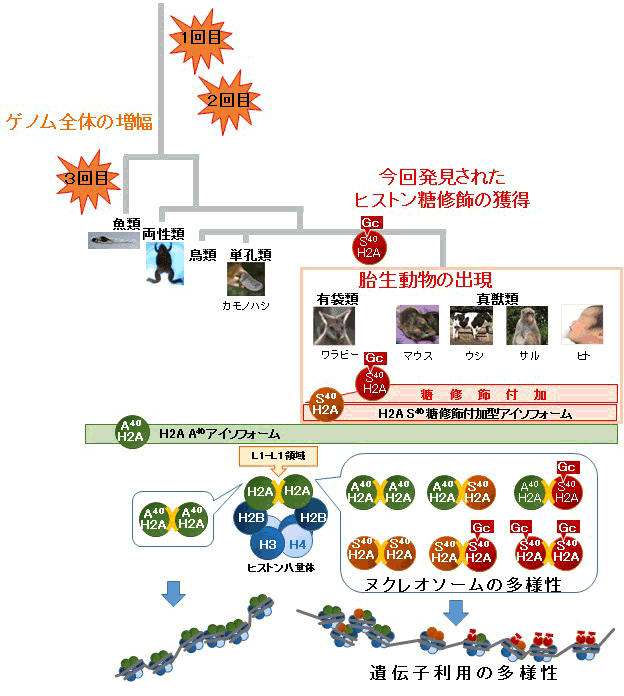
(図1)進化過程におけるH2AS40糖修飾の獲得:進化上、一つのアミノ酸の置換によって新規ヒストン糖修飾が獲得された。ヒストン修飾によるヌクレオソーム構造の多様性が遺伝子利用の多様性に繋がり、胎生動物の出現に寄与した可能性がある。
用語解説
- (注1)エピジェネティクス:DNAの塩基配列の変化を伴わずに細胞分裂後も伝達される遺伝子機能の変化について探求する学問領域を意味する。DNAメチル化とヒストン修飾の組み合わせによって、ヌクレオソーム構造が変化し、遺伝子の活性化状態やゲノムの安定化、およびDNA複製などの調節を行う。
- (注2)ヒストン修飾:ヒストン修飾は、エピジェネティック修飾の一つである。ヒストン分子は様々な化学修飾を受けている。中でも糖によるヒストンの修飾に近年関心が持たれている。ヒストンがどの分子で修飾されるか、また、ヒストンのアミノ酸配列中のどのアミノ酸が修飾されるかによって、遺伝子の活性化あるいは休眠の状態を作りだす。
- (注3)ヌクレソーム:染色体の基本構成単位で、8個のヒストン分子を芯として、DNAが2回巻き付いた構造である。ヌクレオソームが集まって、折りたたまれ凝縮しクロマチンとなる。クロマチンがさらに折りたたまれたものが染色体である。
- (注4)アイソフォーム
基本的機能にかかわるアミノ酸配列は共通しているが、一部の配列が異なっているタンパク質をアイソフォームという。
発表者
- 廣澤瑞子 (東京大学大学院農学生命科学研究科 応用動物科学専攻 助教)
- 早川晃司 (東京大学大学院農学生命科学研究科 応用動物科学専攻 特任助教)
- 田中 智 (東京大学大学院農学生命科学研究科 応用動物科学専攻 准教授)
- 堂前 直 (理化学研究所 環境資源科学研究センター 生命分子解析ユニット ユニットリーダー)
- 新井大祐 (早稲田大学 理工学術院総合研究所 次席研究員・研究院講師)
- 塩田邦郎 (早稲田大学 理工学術院総合研究所 上級研究員・研究院教授/東京大学大学院農学生命科学研究科 名誉教授)
発表内容
① 研究の背景
ヒストンは、長いゲノムDNA分子を折りたたんで核内に収納するという、生命現象の根源に深くかかわるタンパク質で、多くのアイソフォームが存在している。ヒストンアイソフォーム群は相同性が極めて高く、数個のアミノ酸しか違わないため、これまで、アイソフォーム間での機能差は議論されずにきた。ヒストンがさまざまな化学修飾を受けることにより、エピジェネティック制御の中心として、遺伝子発現の制御に関与する。体を構成するすべての細胞で同じゲノムDNAを持っているにもかかわらず、細胞固有の遺伝子の利用ができるのは、ヒストン化学修飾を基盤とするヌクレオソームの多様性によるところが大きい。
単糖であるN-アセチルグルコサミンがセリン(Ser)あるいはスレオニン(Thr)残基に付加する翻訳後の糖修飾も、メチル化やアセチル化と並んで、新たなヒストン化学修飾として提唱されている。この糖修飾自体、一般的に栄養応答性を有することから、新たなエピジェネティックパラメーターとして有用であると考えられる。しかし、修飾の安定性や微量な修飾量が問題となるのか、糖修飾同定の再現が困難で、ヒストン糖修飾の研究はこれまで限られていた。
ゲノムDNA全体の増幅は進化上、重要な位置を占めている。真核生物が誕生し脊椎動物に至るまでに2回のゲノム全体の増幅が起こり、魚類への進化の過程で、3回目の増幅があったことが分かっている。このように3回目の増幅は哺乳類の進化へはつながっていない。どのようなゲノム変化が哺乳類への進化を可能にしたのだろうか?胎盤獲得という進化上の一大イベントは、必要な遺伝子が新規に誕生したというより、すでに存在する遺伝子をいかに使うかに鍵があったと考えられる。
② 研究内容
本研究グループは、マウス胚性幹細胞から精製したコアヒストンの質量分析により、糖修飾部位の候補群を同定し、糖ペプチドライブラリーを作製した。それを抗原として得られた単クローナル抗体20B2は、HPLCによるヒストン分画および組換え変異体利用の組み合わせにより、H2AのL1領域にあたる40番目のセリンに付加する糖修飾を認識することが判明し、最終的にその存在が質量分析により確認された。糖修飾特異的な単クローン抗体が得られたことにより、その生物学的機能の解明が飛躍的に進むことが期待できる。
興味深いことに、ゲノム情報を解析すると、酵母から単孔類に至るまでは、H2Aの40番目のアミノ酸がアラニンであるアイソフォーム(H2AA40)のみしか存在しない。例えば、ゼブラフィッシュ、カエルで、29個、カモノハシでも24個からなるヒストンアイソフォーム群のすべてが、糖修飾がつけないH2AA40タイプのアイソフォームである。一方、胎生動物以降になって、40番目のアミノ酸がアラニンではなく、糖修飾が付加できるセリンであるアイソフォーム(H2AS40)が出現してきたことがわかった。胎生動物のワラビーは、5個からなるアイソフォーム群中3個、マウスでは18個中13個、そしてヒトでは、17個中4個が糖修飾型アイソフォームである。したがって、新規のヒストン糖修飾は、胎生動物にのみ存在するアイソフォーム特異的な修飾であるという特徴をもち、ヒストンアイソフォーム間のわずかな差異も無視できないことがわかった。
進化上、保存性が極めて高いヒストンアイソフォーム間で生まれたわずか一つのアミノ酸の置換が、新たなヒストン修飾の獲得をひきおこした。L1領域は、ヒストン8量体に含まれるH2A分子同士が会合する領域で、そこでの糖修飾の有無はヌクレオソーム構造に大きな変化をもたらすと考えることができる。新しい糖修飾の獲得によって生じたヌクレオソームの多様性が、遺伝子利用の多様性を生み、胎生動物の出現に繋がった可能性がある。
③ 社会的意義
胎生動物特異的なヒストン糖修飾の発見は極めて新規性に富んでいる。この糖修飾はグルコース代謝と密接な関係にあると考えられ、胎生による発生機構の解明に加え、哺乳類特有の代謝関連疾患の治療に対して、栄養という視点から、新規ヒストン糖修飾をインデックスとしたアプローチが可能となる。
発表雑誌
雑誌名:「Scientific Reports」
論文タイトル:Novel O-GlcNAcylation on Ser40 of canonical H2A isoforms specific to viviparity.
著者: Mitsuko Hirosawa*, Koji Hayakawa*, Chikako Yoneda, Daisuke Arai, Hitoshi Shiota, Takehiro Suzuki, Satoshi Tanaka, Naoshi Dohmae and Kunio Shiota*
論文URL:http://www.nature.com/articles/srep31785







