理化学研究所(理研)田中生体機能合成化学研究室の田中克典准主任研究員、岩田隆幸研修生(研究当時)、早稲田大学理工学術院の中尾洋一教授、大塚悟史助手らの国際共同研究グループ※は、天然有機化合物である「アゲラジンA[1]」の新しい誘導体を簡便に合成する手法を開発しました。また、合成した誘導体の中からマウス神経幹細胞[2]のニューロン(神経細胞)への分化を選択的に促進する誘導体と抑制する誘導体を発見しました。
アゲラジンAは国際共同研究グループの1人である中尾洋一教授らによって、2003年に発見された海産アルカロイド[3]で、抗がん作用を示すことが知られています。今回、国際共同研究グループは、アニリンまたはアルギニンを原料として、一つのフラスコ内に4種類の試薬を順番に加えることで、7種類の反応を一挙に行う「ワンポット合成[4]」を開発しました。この方法では中間体を精製する必要が全くないため、簡便かつ短時間にアゲラジンAや、これまで合成できなかった新しい誘導体を得ることができます。
さらに、新しく合成した誘導体について、マウスのES細胞[5]から得られる神経幹細胞(各神経細胞のもとになる細胞)の分化調節活性を調べたところ、10ナノモル(nM、1nMは10億分の1M)という極低濃度でニューロンへの分化を選択的に促進する誘導体と抑制する誘導体を見出しました。このように、ワンポット合成により、天然有機化合物を神経分化調節分子へと変換することに成功しました。
本研究は、神経幹細胞からニューロンへ選択的に分化させる技術へつながる可能性があります。今後、神経分化のメカニズムの解明やアルツハイマー病、ダウン症などの神経変性疾患の治療法の開発に貢献すると期待できます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(さきがけ)の研究領域「分子技術と新機能創出」(研究総括:加藤隆史)研究課題名「生体内合成化学治療:動物内での生理活性分子合成」(研究者:田中克典)の一環として行われました。
成果は、ドイツの科学雑誌『Chemistry – A European Journal』のオンライン版(8月25日付け)に掲載されました。
※国際共同研究グループ
- 理化学研究所 田中生体機能合成化学研究室
准主任研究員 田中 克典 (たなか かつのり)
研修生(研究当時) 岩田 隆幸 (いわた たかゆき)
(現 九州大学先導物質化学研究所 助教)
研修生 坪倉 一輝 (つぼくら かずき) - 早稲田大学 理工学術院
教授 中尾 洋一 (なかお よういち)
次席研究員 新井 大祐 (あらい だいすけ)
助手 大塚 悟史 (おおつか さとし) - 大阪大学大学院 理学研究科
教授 深瀬 浩一 (ふかせ こういち) - カザン連邦大学 A. Butlerov Institute of Chemistry
准教授 アルミラ・クルバンガリエバ(Almira Kurbangalieva)
1.背景
天然有機化合物は、これまで一世紀以上にわたって新たな生物活性化合物または医薬品リード化合物[6]の供給源として注目され、新たな単離手法や生物活性の評価法が開発されています。一方で、天然有機化合物が持つ生物活性を向上させるため、あるいは元の活性とは全く異なる生物活性を新たに見出すために、天然有機化合物の構造の一部を合成化学的に変換する手法も盛んに研究されています。
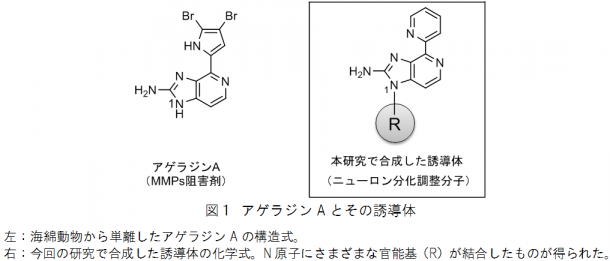
「アゲラジンA」は、2003年に国際共同研究グループの1人である中尾洋一教授らによって発見された海産アルカロイドです(図1)。細胞外基質の分解・代謝を担うタンパク質分解酵素であるマトリックスメタロプロテアーゼ(MMPs)の阻害剤として単離された分子で、抗がん作用を示すことが知られています。これまでに、MMPsの阻害活性や抗がん作用の向上を目指して、アゲラジンAの誘導体が合成されてきました。しかし、これまでの方法では、多くの反応ステップや中間体の精製過程を経なければならないため、作ることのできる化合物はごく一部に限られていました。そこで、国際共同研究グループはアゲラジンAや新しい誘導体を短時間で簡便に合成する新たな方法を開発し、これまでのMMPs阻害活性や抗がん活性とは全く違う活性を持つ誘導体を見出すことを目指しました。
2.研究手法と成果
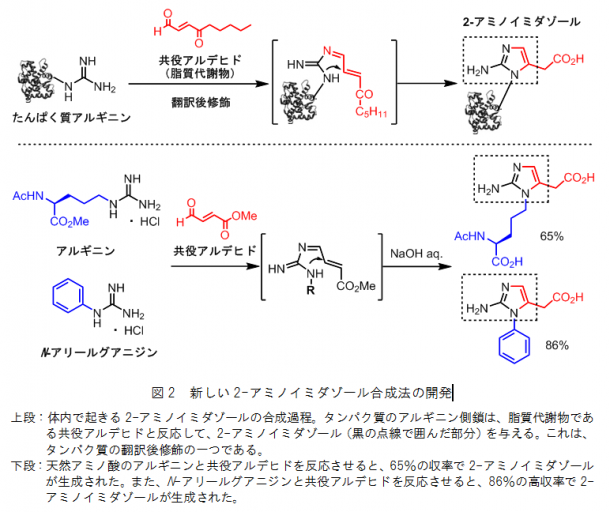
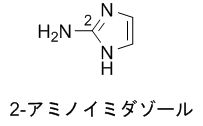
国際共同研究グループはまず、アゲラジンAが持つ「2-アミノイミダゾール[7]部位」を合成する方法を検討しました。自然界では、翻訳後修飾[8]という現象により、タンパク質アルギニン側鎖の「グアニジン(HN=C(NH2)2)」が、脂質代謝物である「共役アルデヒド(アルデヒド基のC=Oの二重結合と共役する二重結合をもつ化合物)」と反応して、2-アミノイミダゾールが生成されます(図2上段)。この反応に注目にして、アルギニンを含むさまざまなグアニジンと共役アルデヒドの反応性を検討しました。その結果、アルギニンと共役アルデヒドの反応では収率が65%、N-アリールグアニジンと共役アルデヒドの反応では86%の高収率で2-アミノイミダゾールが生成されることが分かりました(図2下段)。
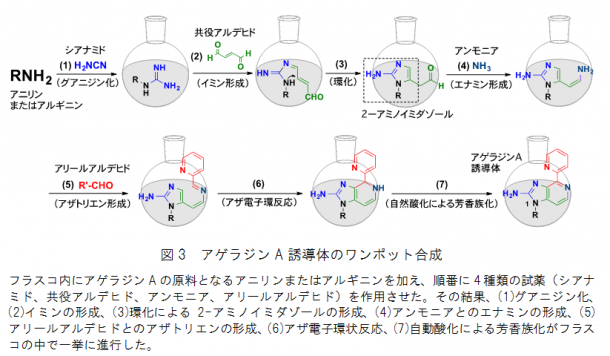
次に、この自然界の反応を利用して、一つのフラスコ内で試薬を順に加えることにより、中間体を全く精製することなく、アゲラジンAやその誘導体を一挙に短時間で合成する「ワンポット合成」を計画しました。さまざまな検討の結果、フラスコ内にアゲラジンAの原料となるアニリン、またはアルギニンを加え、順番に4種類の試薬(シアナミド、共役アルデヒド、アンモニア、アリールアルデヒド)を作用させました。
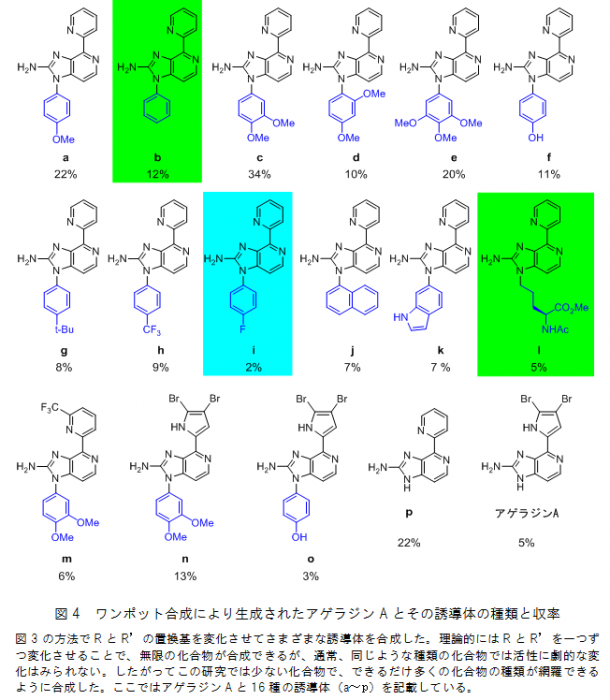
その結果、(1)グアニジン化、(2)イミンの形成、(3)環化による2-アミノイミダゾールの形成、(4)アンモニアとのエナミンの形成、(5)アリールアルデヒドとのアザトリエンの形成、(6)アザ電子環状反応、(7)自然酸化による芳香族化の7種類の反応がフラスコの中で一挙に進行しました(図3)。このワンポット合成により、アゲラジンAのほかに、これまで合成できなかったさまざまなアゲラジンAの誘導体(16種)が合成できました。中でも誘導体cは34%という高収率で合成することができました(図4)。
続いて、合成したアゲラジンAの誘導体をマウスのES細胞から調製した神経幹細胞(各神経細胞のもとになる細胞)に作用させ、ニューロン(神経細胞)への分化に与える影響を調べました。
その結果、図4に示した2種類の誘導体bおよびlでは、ニューロンへの分化が著しく進みました。これは、神経細胞への分化を促すことが知られている化合物「ハルミン(Dyrk1A阻害剤)[9]」を上回る分化促進活性であり、10ナノモル(nM、1nMは10億分の1M)という極低濃度においても活性を保持していました。また別の誘導体iは、逆にニューロンへの分化を10nMで抑制することも分かりました。さらに、一般的に神経幹細胞はニューロンだけでなく、グリア細胞(神経系を構築する細胞のうち神経細胞ではない細胞の総称)の一つであるアストロサイトなどにも分化しますが、今回見出した三つの誘導体はアストロサイトへの分化には全く影響を与えませんでした。このようにアゲラジンAの誘導体は、ニューロンへの分化だけに影響を与えることが明らかになりました(図5)。
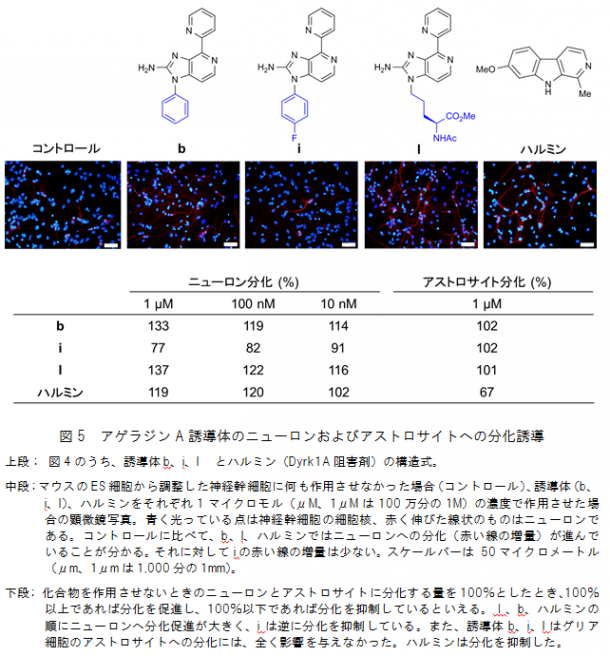
さらに、ニューロンへの分化活性発現メカニズムを調べるために、誘導体bについて、遺伝子オントロジー[10]データベースをもとに、ニューロンへの分化に関わる計26種のキナーゼ(リン酸化酵素)に対する阻害実験を行いました。その結果、誘導体bを神経幹細胞に作用させたときには、非特異的なキナーゼ阻害がなくなり、このためにニューロン選択的な分化促進活性を示すことが示唆されました。
3.今後の期待
低分子化合物によって幹細胞から特定の細胞、例えば、ニューロン、アストロサイト、あるいはオリゴデンドロサイトへと分化させる方法はまだ十分には確立されていません。ある細胞への分化を促進する分子は、別の細胞への分化を抑制するなど、複雑な因果関係のもと制御されているからです。
本研究によって見出された天然有機化合物の誘導体は、神経幹細胞のニューロンへの分化のみを選択的に促進または抑制できます。本成果は、今後、複雑な神経分化のメカニズムの解明や、さらにはダウン症やアルツハイマー病などの神経疾患に対する治療法の開発に貢献すると期待できます。
4.論文情報
タイトル
著者名
Takayuki Iwata, Satoshi Otsuka, Kazuki Tsubokura, Almira Kurbangalieva, Daisuke Arai, Koichi Fukase, Yoichi Nakao, Katsunori Tanaka
雑誌
Chemistry – A European Journal
DOI
10.1002/chem.201602651
5.補足説明
- [1] アゲラジンA
海綿動物Agelas nakamuraiより単離された海産アルカロイド。細胞外基質の分解・代謝を担うタンパク質分解酵素の一群であるマトリックスメタロプロテアーゼ(MMPs)の阻害活性と、これに伴う血管新生(既存の血管から新しい血管を作る生理現象)の阻害活性を持つ。 - [2] 神経幹細胞
ニューロン(神経細胞)およびグリア細胞(神経系を構築する細胞のうち神経細胞ではない細胞の総称)へと分化する能力を持つ幹細胞。グリア細胞にはミクログリア、アストロサイト、オリゴデンドロサイトなどのニューロン以外の神経系を構成する細胞がある。 - [3] 海産アルカロイド
アルカロイドは、主に窒素原子を持つ植物由来の天然有機化合物の総称。海綿動物由来の化合物にも窒素を含む天然有機化合物が多数存在し、一般的にこれらをまとめてアルカロイドと呼ぶ。海産アルカロイドは多種多様な生理活性を示すことが知られており、創薬のリード化合物として利用されることも多い。 - [4] ワンポット合成
フラスコに入れた原料化合物に対して、反応試薬を順次作用させることで多段階の反応を一挙に行う手法。通常の有機合成では一段階ずつ反応を停止させ、精製作業を行った後、次の反応を行うが、ワンポット合成では多段階の反応を停止させることなく行う。そのため、通常の合成法よりも反応の制御は難しくなるが、一方で時間を要する精製作業を省略することができるため短時間に目的の化合物を合成できる。 - [5] ES細胞、iPS細胞
ES細胞は受精卵が分化してできた発生初期の胚の細胞から作られ、すべての細胞に分化する能力を持つ。iPS細胞は線維芽細胞などの分化細胞に、3~4個の転写因子を導入するなどして作られた多分化能を持つ細胞。ES細胞のように、あらゆる細胞に分化する能力がある。ES細胞が抱える倫理的問題を解決できると考えられており、また患者自身の細胞から作ることができるので、iPS細胞から分化した細胞を患者に移植しても拒絶反応が起きにくいと考えられている。 - [6] 医薬品リード化合物
望ましい生理活性を示す化合物を医薬品として使うためには、体内での安定性や動態、あるいは毒性や副作用など、さまざまな条件を満たさなければならない。そのために化合物の構造を順次変化させていくが、その元となる最初の化合物をリード化合物と呼ぶ。 - [7] 2-アミノイミダゾール
下記の構造で示される有機化合物。多くの生理活性化合物に含まれ、その合成法は有機化学において非常に重要である。
- [8] 翻訳後修飾
タンパク質がDNA情報をもとに作られる過程を翻訳と呼び、翻訳後のタンパク質が化学的な修飾を受けることを翻訳後修飾と呼ぶ。一般的には、酵素によって糖やリン酸などが付加されることにより、そのタンパク質本来の機能を示すようになる。今回着目した2-アミノイミダゾールを与える翻訳後修飾では、酵素を介さず脂質代謝物である共役アルデヒドと反応する。 - [9] ハルミン(Dyrk1A阻害剤)
Dyrk1Aは、神経細胞の増殖や分化を抑制するセリン・スレオニンキナーゼで、ダウン症やアルツハイマー症に関与していることが知られている。Dyrk1Aを阻害する化合物はこれらの治療薬として期待されている。ハルミンはDyrk1Aを阻害する典型的な化合物であり、神経幹細胞からニューロンへの分化を促すことが知られている。Dyrk1A はDual Specificity Tyrosine-Phosphorylation-Regulated Kinase1Aの略。 - [10] 遺伝子オントロジー
遺伝子の機能に関する用語を分子機能、細胞の構成要素、生物的プロセスに分類した生物学分野における共通語彙集。これをデータベース化したものを遺伝子オントロジーデータベースと呼び、例えば、ある用語でデータベースを検索すると、その用語をアノテーション(注釈)に持つ遺伝子の一覧を得ることができる。本研究では神経分化に関わるキナーゼを選択した。
6.発表者
- 理化学研究所 田中生体機能合成化学研究室
准主任研究員 田中 克典(たなか かつのり)
研修生(研究当時) 岩田 隆幸(いわた たかゆき)
(現 九州大学先導物質化学研究所 助教)
TEL:048-467-9405 FAX:048-467-9379
E-mail:[email protected](田中) - 早稲田大学 理工学術院
教授 中尾 洋一(なかお よういち)
助手 大塚 悟史(おおつか さとし)
TEL:03-5286-3100(中尾)
E-mail:[email protected](中尾)[email protected](大塚)