研究概要
動植物の熱発生や温度知覚センサーに関する研究は、臓器レベルで理解が進み、温度感受性タンパク質が次々に同定されています。しかし個々の細胞がどのように外部の温度変化に応答するのか、センサー以外のタンパク質は細胞内でどのように応答するのか、細胞内での熱発生はどうなっているのか、といった、細胞内で起きるミクロな現象は未だ十分に理解されていません。そこで私たちは、細胞内の局所的かつ僅かな温度変化の測定を可能にする新たな手法を開発しました。今回開発した蛍光ナノ温度計粒子の蛍光強度(明るさ)は温度によって変化し、他の環境因子(pHとイオン強度)には影響されません。そのため、環境が時々刻々変化する細胞内の局所的な温度を、正確に素早く測定することが可能となりました。さらにこのナノ温度計は細胞内で分子モーターによって輸送され、「細胞内を歩くナノ温度計」として働くことが見いだされました。この成果は国際科学雑誌『Lab on a Chip』に掲載予定で、それに先立ちオンライン版に掲載されました。
本研究の背景と目的
動物、植物に関わらず、生き物には温度を感じる機構と、熱を生じる機構が存在します。現在、これらの役割を担うタンパク質の同定と動作機構の解明が進んでいます。個々の細胞レベルでも、内部で生じる化学反応速度の変化などとして温度を「感じている」と考えられますが、そもそも細胞と同程度の微小スケール(マイクロ・ナノメートルオーダー)での温度測定技術が、十分に発達していません。
微小空間の温度測定法の一つに、光学顕微鏡を用いた蛍光温度測定法があります。蛍光色素の明るさ(蛍光強度)が温度によって変化する性質を用いて、観察対象の局所的な温度測定を行う手法がいくつか報告されています。その一方で、一般に蛍光強度は温度以外の環境因子(pHやイオン強度)によっても変化する性質をもっており、これが正確な温度測定を妨げていました。
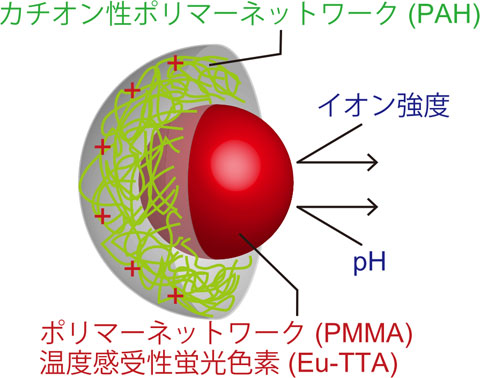
そこで私たちは、蛍光色素を高分子鎖のネットワークで包むことで、環境因子の遮断を試みました(図1)。
本研究で開発した新しい手法
私たちは蛍光を発する中心核の粒径が約110 nmの蛍光ナノ粒子を開発しました。この粒子の蛍光強度は温度によって変化しますが、pHやイオン強度によっては全く変化しない性質があること(ナノ温度計)が確かめられました(図2)。さらに私たちが以前に開発した、顕微鏡下で局所的に熱パルスを与える手法と組み合わせることで、一粒一粒の蛍光ナノ粒子の応答を解析しました。そして応答速度は57.9Hz以上、1秒間の温度分解能と観察時の空間分解能はそれぞれ0.3℃、5.3 nmと見積もられました(図3)。
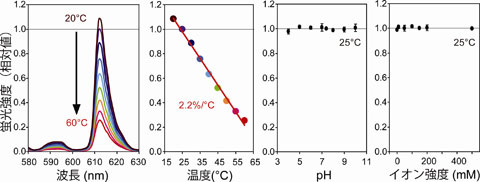
図2ナノ温度計の蛍光強度と温度、pH、イオン強度の関係。
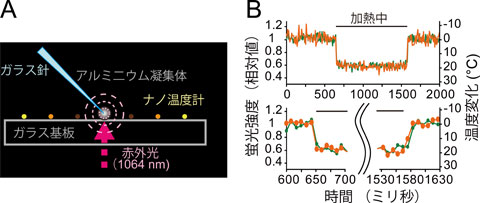
図3ナノ温度計の応答速度(A)ガラス基板上のナノ温度計に局所的な熱パルスを加えた。ガラス針の先端のアルミニウム粉末凝集体に赤外光を集光することで、周囲に同心円状の温度勾配を発生させた。(B)熱パルスに対するナノ温度計の蛍光強度の応答。2フレーム(17.3ミリ秒)以内に応答していることがわかる。
本研究で得られた結果と知見
私たちは、細胞にふりかけるだけで自発的に細胞内へ導入されるようにナノ温度計を設計しており、ヒト由来のガン細胞(HeLa細胞)でそれを確かめました。この過程で、導入された粒子が酸性の細胞内小器官であるエンドソームに包まれて、細胞内を一方向に輸送されることを発見しました。そしてこの輸送は、エンドソームに結合している微小管分子モーターの働きによることを示すことができました。こうして、これは私たちの開発した蛍光ナノ粒子が、生きた細胞内で「歩くナノ温度計」として機能することを示しています。
さらにこの輸送されているナノ温度計に対して細胞外部から瞬間的な熱パルスを与えると、粒子の輸送速度が熱パルスの間だけ著しく増加する現象が見られました。そして、蛍光ナノ粒子の位置と蛍光強度の時間変化を動画の画像解析から求めることによって、細胞内小器官の位置と温度を高時間・空間・温度分解能で測定できることを示すことに成功しました(図4)。
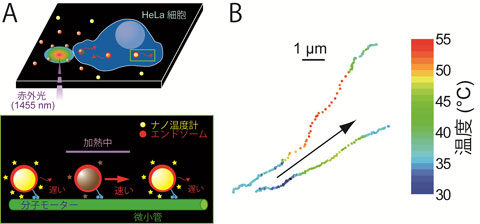
図4 細胞内を歩くナノ温度計(A)ナノ温度計は細胞内でエンドソームに包まれ、微小管の上を分子モーターによって輸送される。この輸送中のナノ温度計に熱パルスを与えると、力学酵素である分子モーターの酵素機能が活性化され、粒子の移動速度は上昇する。同時に、温度上昇に伴って蛍光強度は減少する。(B)実際に観察されたエンドソームの位置と温度の高分解能マッピング。矢印は移動方向を示す。
本研究の波及効果
本研究で開発した“歩くナノ温度計”とこれを用いた測定手法により、細胞内で働くタンパク質の動態とその局所温度依存性との関係を、細胞内で初めて測定することができました。ミクロンサイズの細胞内小器官について、その内部の温度変化を直接測定したのは世界で初めてです。また生きた細胞の中で、世界最高レベルの空間分解能で、温度変化や分布を高速に測定できる手法であることも示されました。ナノ温度計の細胞毒性は非常に低く、学術研究で用いられる一般的な蛍光顕微鏡で測定が可能な簡便さもポイントの一つです。この手法を応用することで、例えば細胞代謝に関する研究において細胞一個のレベルから詳細に解析することが可能になるなど、基礎医学分野への波及効果が期待されます。
またここで開発された手法は、細胞に限らず、一般に、水溶液中(特にpHやイオン強度などが激しく変わる可能性がある場合)の温度変化を非接触な方法で測定したいという工業的用途を含めた、幅広い分野からのニーズにも応用可能です。
論文題目
Walking nanothermometers: Spatiotemporal temperature measurement of transported acidic organelles in single living cells
歩くナノ温度計:生きた単一細胞中で輸送される酸性小器官の、温度と位置のリアルタイム同時計測
Lab on a Chipオンライン版(2012年3月11日現在):
http://pubs.rsc.org/en/content/articlelanding/2012/lc/c2lc00014h
著者
- 大山廣太郎(早稲田大学先進理工学研究科博士後期課程3年・日本学術振興会特別研究員(DC1))
- 高林昌生(早稲田大学先進理工学研究科卒業)
- 武井義明(早稲田大学先進理工学研究科修士課程1年)
- 新井敏(早稲田大学先端科学・健康医療融合研究機構招聘研究員)
- 武岡真司(早稲田大学理工学術院教授,早稲田バイオサイエンスシンガポール研究所副所長)
- 石渡信一(早稲田大学理工学術院教授,早稲田バイオサイエンスシンガポール研究所所長)
- 鈴木団(早稲田バイオサイエンスシンガポール研究所主任研究員)
リンク
以上