理工・大島研など
脊髄損傷における新たな治療標的タンパク質を特定
より特異的・効果的な神経再生医療に期待

記者説明会で研究成果を解説する長井淳氏
「脳や脊髄からなる中枢神経系は、ひとたび損傷してしまうと非常に再生が起きにくい」。100年以上前、神経学者の父カハールが提唱した通り、損傷後の脊髄においては炎症反応、瘢痕形成、神経変性など数多くの阻害反応があります。これまで、こうした阻害反応ひとつひとつを制御する試みはなされてきましたが、全ての阻害反応を一挙に制御する分子の研究報告はありませんでした。今回、早稲田大学理工学術院の大島登志男教授(先進理工学研究科生命医科学専攻)、長井淳日本学術振興会特別研究員(DC1、同博士後期課程2年)、横浜市立大学医学部分子薬理神経生物学研究室(五嶋良郎教授)らの研究グループは、細胞骨格を制御するタンパク質として知られているCRMP4という分子に着目し、CRMP4を抑制することで神経再生を阻害するいくつかの因子を同等にブロックできることを明らかにしました。

横浜市立大の五嶋良郎教授に謝辞を述べる大島登志男教授
これまで同定されてきた阻害因子の多くは、他の組織にも影響力をもつため、強い副作用(実験動物における致死性など)が懸念されてきました。ところが、今回用いたCRMP4遺伝子欠損マウスは、野生型マウスと遜色なく正常に生育し、行動の異常は観察されていません。これらのことは、CRMP4を治療標的にした場合の副作用が従来の治療に比べ明らかに少ないことを強く示唆しています。iPS細胞等の幹細胞移植による再生医療が注目を集めていますが、仮に中枢神経系に神経幹細胞が移植され、神経細胞数が増えたとしても、細胞外の阻害因子により神経再生が限定されてしまう可能性も無視できません。しかし、例えば、移植する幹細胞内のCRMP4を常時不活性にすることができれば、神経細胞新生と軸索再生のシナジー効果が生み出され、格段に効果的な神経系再生が期待されます。また、同じく治療法が確立していない脳卒中・アルツハイマー病やパーキンソン病などについても、今回の発見が中枢神経系疾患の汎用的メカニズムであると考えた場合、今後の脳損傷・脳疾患に対する神経再生医療研究に大いに貢献する可能性があります。
なお、今回の研究成果は、英国科学誌「Scientific Reports」(Nature Publishing Group)オンライン版に、2月5日に掲載されました。
問合せ先:大島研究室 電話(03-5369-7321)
(1)これまでの研究で分かっていたこと
「脳や脊髄からなる中枢神経系は、ひとたび損傷してしまうと非常に再生が起きにくい」。100年以上前、神経学者の父カハールはこう提唱しました。例えば、脊髄損傷後の再生には炎症反応、瘢痕形成*1、神経変性など数多くの阻害反応が立ちはだかっています。これまで阻害反応ひとつひとつを制御する試みはなされてきました。しかし、全ての阻害反応を一挙に制御する分子の研究報告はありませんでした。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
今回我々はCRMP4という分子に着目しました。CRMP4は細胞骨格*2を制御するタンパク質として知られています(Nagai et al., 2012)。細胞骨格は神経再生に対するすべての阻害反応に関与するため、CRMP4を抑制することで神経再生を阻害するいくつかの因子を同等にブロックすることになるという仮説をおきました。
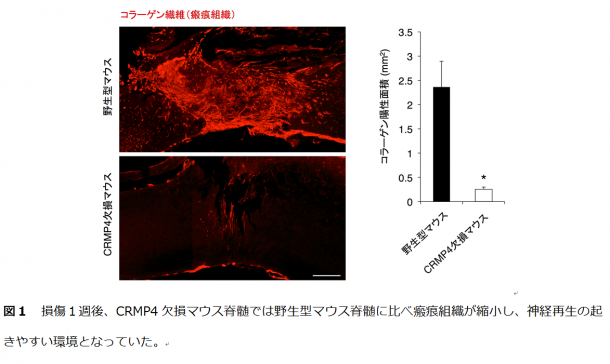
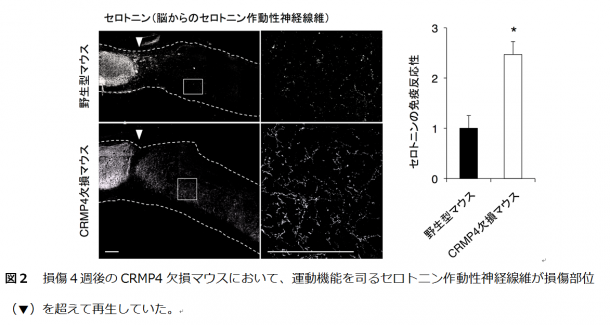
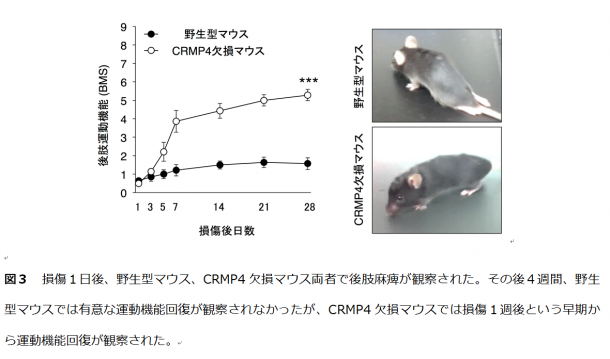
まず、CRMP4が損傷した脊髄の神経細胞、炎症性細胞どちらにおいても上昇することを見い出しました。また、CRMP4遺伝子欠損マウスでは、炎症・瘢痕形成・神経変性反応が抑制され、脊髄損傷により麻痺していた後肢の回復が顕著であることを発見しました。後肢機能の改善は損傷1週後という非常に早期から観察され、CRMP4の抑制がいかに効果的かを物語っています。
(3)そのために新しく開発した手法
研究グループは分子同士の一対一対応の関係を明らかにするために、主に培養系実験によるCRMPの機能解明を行ってきました(Nagai et al., 2012)。しかし、自由に条件を定められる培養系実験とは異なり、生体内では未だ明らかになっていない要因が複合的に関わっている事が容易に想像されます。そこでCRMP4遺伝子欠損マウスを用いて、脊髄損傷後の神経系再生過程におけるCRMP4の機能を個体レベルで検証しました。
(4)今回の研究で得られた結果及び知見
まず、野生型マウスの損傷脊髄において、神経細胞、炎症性細胞内でCRMP4の発現上昇が認められました。また、CRMP4のアイソフォーム*3のうち、特に再生阻害効果の強いフォームが上昇していることが確認されました。そこで研究グループが作製したCRMP4 遺伝子欠損マウスを用い、脊髄損傷後の再生過程を野生型マウスと比較しました。CRMP4 遺伝子欠損マウスにおいて、損傷1週後では神経変性、炎症反応、瘢痕形成いずれの現象も抑制され(図1)、損傷4週後では運動機能を司る神経繊維の再生が観察されました(図2)。これらの結果は、CRMP4 遺伝子欠損マウスにおいて損傷早期から後肢運動機能が改善していること(図3)と一致していることが見い出されました。
(5)研究の波及効果や社会的影響
副作用のない薬は存在しませんが、分子標的薬のように治療標的が特異的に絞られている場合は、副作用を最小限に抑えることができます。これまで同定されてきた阻害因子の多くは、他の組織にも影響力をもつため、強い副作用(実験動物における致死性など)が懸念されてきました。ところが、今回用いたCRMP4遺伝子欠損マウスは、野生型マウスと遜色なく正常に生育し、行動の異常は観察されていません。これらのことは、CRMP4を治療標的にした場合の副作用が従来の治療に比べ明らかに少ないことを強く示唆しています。
一方、昨今iPS細胞等の幹細胞移植による再生医療が注目を集めています。しかし、仮に中枢神経系に神経幹細胞が移植され、神経細胞数が増えたとしても、細胞外の阻害因子により神経再生が限定されてしまう可能性も無視できません。ところが、例えば移植する幹細胞内のCRMP4を常時不活性にすることができれば、神経細胞新生×軸索再生のシナジー効果が生み出され、格段に効果的な神経系再生が期待されます。
他の中枢神経系疾患として、同じく治療法が確立していない脳卒中・アルツハイマー病やパーキンソン病などがあります。今回の発見が中枢神経系疾患の汎用的メカニズムであると考えた場合、今後の脳損傷・脳疾患に対する神経再生医療研究に大いに貢献する可能性があります。
(6)今後の課題
CRMP4には活性の異なるアイソフォームがいくつか報告されています。各アイソフォームがどのように再生阻害効果をもたらしているのかという詳細の分子機構が明らかになれば、それぞれを特異的に阻害する化合物や抗体医薬が中枢神経系の治療に寄与することが期待されます。
説明図
用語解説
1) 瘢痕形成:損傷や炎症により懐死した組織が、コラーゲン繊維などを主とする結合組織(瘢痕組織)に置き換わってしまうこと。瘢痕組織は神経再生の物理的障壁になるだけでなく、阻害因子を分泌するなどして化学的障害にもなる。
2) 細胞骨格:すべての細胞に存在し、細胞形態の変化に大きく関与する。たとえば、炎症反応における炎症性細胞の分裂・移動や、神経再生における神経突起の伸長などを制御する。
3) アイソフォーム:タンパク質を構成するアミノ酸配列が非常に似通っているが、わずかにアミノ酸配列が違うために異なる活性を持ちうるタンパク質。
本研究は、早稲田大学大学院先進理工学研究科生命医科学専攻の大島登志男教授、長井淳日本学術振興会特別研究員(DC1、博士後期課程2年)、横浜市大医学部分子薬理神経生物学研究室(五嶋良郎教授)らの研究グループによるもので、英国科学誌「Scientific Reports」(Nature Publishing Group)オンライン版に2015年2月5日、掲載されました。
Crmp4 deletion promotes recovery from spinal cord injury by neuroprotection and limited scar formation
Jun Nagai, Yoshiteru Kitamura, KazukiOwada, Naoya Yamashita, Kohtaro Takei, Yoshio Goshima and Toshio Ohshima.
なお、本研究成果は、日本学術振興会特別研究員DC1の研究課題「中枢神経系損傷後の再生における軸索ガイダンス分子CRMPの機能解明」の支援および日本学術振興会科学研究費基盤研究(C)の支援を得て行われました。


