熱を生み出す褐色脂肪細胞の温度変化を「見える化」する技術の開発に成功
シンガポール、米国、日本の国際共同研究の成果、肥満の新しい治療薬探索へ
早稲田大学が重点領域研究の一環で展開してきた早稲田バイオサイエンスシンガポール研究所(WABIOS)において、新井敏(あらいさとし)研究院講師、Hou Yanyan研究補助員、北口哲也(きたぐちてつや)研究院准教授(論文投稿当時)、石渡信一(いしわたしんいち)名誉教授、鈴木団(すずきまどか)研究院准教授(論文投稿当時)・現JSTさきがけ研究者の研究グループが、シンガポール国立大学、シンガポール科学技術研究庁、ハーバード大学と共同で、赤外線サーモグラフィを使えば私たちの体表面の温度分布が見えるように、ミクロンサイズの細胞(ヒト由来の褐色脂肪細胞)が熱を生み出して温度が変化する様子を、光学顕微鏡で見ることができる技術を開発しました。
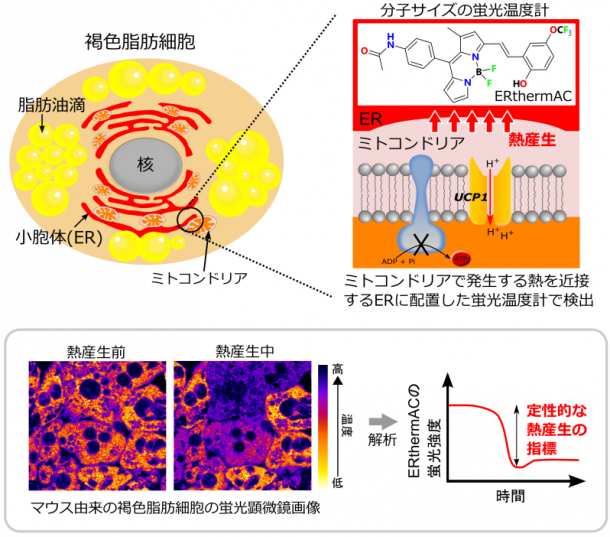
今回、褐色脂肪細胞の温度変化の観察により適した、新しい蛍光温度計「ERthermAC」を、シンガポール国立大学(Young-Tae Chang教授)らと開発することに成功しました。「蛍光温度計」は、温度変化を蛍光シグナルの変化として読み出すことができます。ERthermACはサイズの極めて小さな蛍光物質のため、わずか数分で細胞に導入することが可能です。熱産生を促す薬剤刺激を与えたヒト由来の褐色脂肪細胞へ応用し、同一視野内にある複数の細胞が個別に応答する「個性」を見ることに初めて成功しました。今回の方法では、何℃上がったのかという定量的な解析には限界がありますが、熱産生の有無を判定する定性的な検出に大きな威力を発揮します。短時間のうちに、大量に存在する細胞へ蛍光温度計を均一に導入でき、数時間の観察に耐えうる安定性を持つことから、前段で述べたような肥満の治療薬開発のための簡便なスクリーニング手法の基盤技術となりうる可能性を秘めています。
本研究は、材料化学、物理学、生物学の複数の専門分野の知恵を結集し、最終的に日本、シンガポール、そして米国へと、分野も国境もダイナミックに横断した学際的な研究としての成果です。
今回の研究成果は、英国Nature Publishing Groupのオンライン科学雑誌『Scientific Reports』に2017年5月3日(現地時間)に掲載されました。
(1)これまでの研究で分かっていたこと
現在、先進国や発展途上国に関わらず、肥満の増加が大きな問題となっています。これは、糖尿病、心疾患やアルツハイマー病など多くの病気の一因となるからです。肥満は、私たちが食事から摂取するカロリーの量が、私たちが生きるのに使われる消費カロリーの量を上回ることで生じます。従って、「肥満の対策にはカロリー摂取量を減らすことが有効である」と一応は言えます。しかしながら、私たちの体は元来、飢餓から身を守るためにカロリーを脂肪として貯めこみ易い性質を持つこと、またカロリー摂取を減らした状態へ体が一度適応すると、そこからの体重減少が極めて難しくなるなど、原理的にこのアプローチには限界があることが指摘されています(参考文献1)。
いっぽうで、新しいアプローチとして、摂取量ではなく消費量に着目し、獲得したカロリーを熱として消費する「細胞の熱産生」を促進する薬の開発が精力的に行われるようになってきました。私たちの体の中で熱産生を積極的に行っているのが、褐色脂肪細胞と筋肉の細胞です。特に褐色脂肪細胞は、今まで小型げっ歯類やヒト乳幼児での研究が盛んでしたが、ヒト成人でもその重要性が再認識され、近年、治療薬の標的としても大きな注目を集め始めています。
熱を生む褐色脂肪細胞で、熱産生を促す治療薬を開発するとき、細胞が生み出す熱量を測ることが薬の効きめを判定する最も直接的で正確な方法と思われます。今までは、微小な熱量を検出できる「マイクロカロリメトリー」という手法を用いて、多くの細胞の平均値としての熱産生量を算出するしか方法はありませんでした。しかし、装置が特殊なうえ、実験室の厳密な密閉性などが求められることから実験上の困難さを伴います。従って、現在の生物学の研究室では、熱以外の変化量を細胞の熱産生の指標とみなして間接的に評価するのが主な方法となっています。
そこで、褐色脂肪細胞から生まれた熱によって生じる細胞の温度変化を、蛍光シグナルの変化として読み出すことができる、細胞用の「蛍光温度計」を用いた技術の開発が進められています。新井研究院講師ら(参考文献2)の他にも、京都大学や大阪大学のチームが遺伝子工学的な手法(蛍光タンパク質)を、東京大学のチームがナノゲル粒子を用いた方法を報告しています。しかし大量に存在する褐色細胞に対して、蛍光温度計を均一、簡単に導入して、しかも長時間にわたって安定して温度変化を検出する方法がこれまでに無かったことから、薬剤スクリーニングの指標として温度変化を扱うことができませんでした。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
今回、研究チームは、褐色脂肪細胞からの熱産生を、光学顕微鏡下で1細胞ごとに蛍光温度イメージングして検出する新しい手法を開発しました。蛍光温度計を、マウス由来の細胞だけでなく、ヒト由来の細胞から分化誘導した褐色脂肪細胞に導入し、光学顕微鏡で観察しながら、視野内にある多数の細胞が個別に熱産生して温度変化する様子をリアルタイムで見ることに、初めて成功しました。

左からRókus Kriszt氏、Michael Raghunath博士、新井敏博士
(3)そのために新しく開発した手法
褐色脂肪細胞での計測にとって、より適した化学的な特性を持たせるために、シンガポール国立大学のYoung-Tae Chang教授らが、今までに共同で開発していた蛍光温度計(ER thermo yellow:参考文献2)に改良を施しました(ER thermAC)。更に、最終的な治療薬を探索することを考慮すると、ヒト由来の試料を用いることが望ましいことから、ハーバード大学のYu-Hua Tsengらが独自に開発したヒト由来の細胞から分化誘導した褐色脂肪細胞を用いました。
(4)今回の研究で得られた結果及び知見
まず温度計としての特性を確かめ(①)、次に褐色脂肪細胞へ応用し(②)、同一視野内にある複数の細胞が個別に応答する「個性」を見ることに初めて成功しました(③)。
①従来のER thermo yellowと比較して、化学的・物理的な安定性が高く、かつ長時間の顕微鏡観察にも耐えうるものであることが確かめられました。本研究チームの蛍光温度計は、その大きさが分子サイズであることが特徴です。これにより、蛍光温度計を細胞にふりかけただけで、わずか数分で細胞の中に導入することができます。これまでに報告されている他の手法と比べると、本研究チームの技術は、細胞の種類を選ばず、どんな細胞にでも容易に細胞内へ導入できる点で優れています。
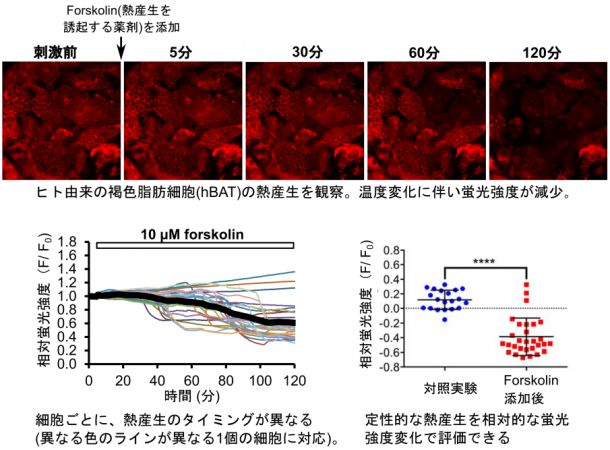
②マウスおよびヒト由来の褐色脂肪細胞を薬剤で刺激したところ、蛍光温度計の蛍光強度が大きく変化しました。細胞の熱産生量を直接測るマイクロカロリメトリーを用いた測定だけでなく、これをエネルギー代謝量として間接的に評価する手法として広く用いられている他の手法(pHや酸素の消費量)から得られる結果とも、非常に良く相関していました。これらの結果を含む複数の異なる計測から、本手法が細胞の熱産生を検出していることを確認しました。
③細胞集団を計測に用いる従来の手法では、1個1個の細胞を個別に解析することができません。しかしここで開発した手法を用いれば、刺激を受けた褐色脂肪細胞の温度変化を1細胞ごとに解析できます。その結果、それぞれの細胞が「異なるタイミング」で熱産生して温度が変わるという個性的な姿を捉えることに成功しました。
(5)研究の波及効果と意義
褐色脂肪細胞の熱産生そのものを、間接的な指標を介さずに、より直接的に観察できる簡便な手法の開発に成功したことになります。同様に熱産生機能を持つ筋肉の細胞などへも、本技術の適用対象は広がっていきます。今後、この手法が創薬のための基盤技術の一つとして普及すれば、今までに無かった視点から熱産生を促す薬を見出し、肥満を引き金にして生じる様々な病気の治療薬の開発へとつながることが期待されます。
今回、本研究を効率よく遂行するために、国際的な研究ハブである在シンガポール拠点が最大限に活かされました。実際に現地で顔と顔をつき合わせて、日夜、顕微鏡を覗きながら徹底的に議論を重ね、実験上生じた問題点は、素早く共同研究者へフィードバックし、問題解決にあたりました。最終的に、ヒトサンプルを用いた実験の必要性が生じたことから、筆頭著者のRókus氏がハーバード大学へ直接赴き、精力的な実験に汗を流しました。世界中でバイオ研究の競争が激化している中、必要な技術を、国境を越えてでもいかに迅速に結集できるかが、我が国が科学技術立国として世界をリードするうえで、今後ますます重要になるものと予想されます。本共同研究を通して実地に構築した国際的なネットワークは、今後も本学にとって大きな強みとなり、我が国を中心として新たな研究成果を生み出していくプラットフォームになるものと期待できます。
(6)今後の課題
刺激を受けてから熱産生までをつなげる情報伝達の仕組みが、細胞内にはあります。本研究で見いだされた細胞の個性は、この情報伝達のばらつきに由来する可能性がありますが、どのステップがどのように効いているのかについてはまだ分かりません。熱産生を促進する薬剤候補が見つかったとして、その機序を理解するためにも、1細胞で温度イメージングできる本技術を他の細胞生物学的、分子生物学的な手法と合わせて、熱産生につながる細胞内情報伝達の仕組みをより詳細に理解することが求められます。
また今回得られたデータは、あくまで定性的な指標であり、細胞内の温度が実際に何℃上昇しているのか、という定量的な議論とは区別する必要があります。現在、細胞の自発的な熱産生に由来する細胞内温度についての意見は大きく割れており、定量的な議論は未だに残されている重要な課題です(参考文献3)。定量性を向上させる改良を施すことで、こうした課題の解決に向けた一つの糸口になると考えられます。
(7)100字程度の概要
熱を生み出す褐色脂肪細胞の温度変化を「見える化」する技術の開発に成功。肥満の新しい治療薬探索のための基盤技術として期待。
論文情報
- 掲載誌:Scientific Reports
- タイトル:Optical visualisation of thermogenesis in stimulated single-cell brown adipocytes
- 著者:Rókus Kriszt, Satoshi Arai(WABIOS), Hideki Itoh, Michelle H. Lee, Anna G. Goralczyk, Xiu Min Ang, Aaron M. Cypess, Andrew P. White, Farnaz Shamzi, Ruidan Xue, Jung Yeol Lee, Sung-Chan Lee, Yanyan Hou(WABIOS), Tetsuya Kitaguchi(WABIOS), Thankiah Sudhaharan, Shin’ichi Ishiwata(WABIOS), E. Birgitte Lane, Young-Tae Chang, Yu-Hua Tseng*, Madoka Suzuki*(WABIOS・JSTさきがけ) and Michael Raghunath* (*Corresponding authors)
- 著者所属:早稲田大学(WABIOS)、JST、シンガポール国立大学、シンガポール科学技術研究庁、ハーバード大学医学部
- DOI:10.1038/s41598-017-00291-9
参考文献
- 1)Y.-H. Tseng(本プレスリリース論文の共著者), A. M. Cypess and C. R. Kahn, Nat. Rev. Drug Discov., 2010, 9, 465–482.
- 2) S. Arai, S.-C. Lee, D. Zhai, M. Suzuki and Y.-T. Chang, Sci. Rep., 2014, 4, 6701.
- 3) M. Suzuki, V. Zeeb, S. Arai, K. Oyama and S. Ishiwata, Nat. Methods, 2015, 12, 802–803.(プレスリリース)









