脂肪肝炎発症メカニズムの一端を発見
肝臓におけるカルシウム恒常性制御機構
発表のポイント
- 脂質代謝や解毒機能など、多様な役割を担う重要な臓器である肝臓の脂質代謝において、「Nwd1遺伝子」が重要な働きを担うことを明らかにしました。
- Nwd1遺伝子を欠失したマウス肝臓では、脂肪の蓄積や線維化、炎症性細胞死などの非アルコール性脂肪肝炎(MASLD/MASH)様の症状が誘導されることを発見しました。そして、Nwd1が、細胞質側から小胞体内へのカルシウム輸送を制御する主要なタンパク質であるSERCA2と相互作用し、小胞体内のカルシウム恒常性を維持するということが分かりました。
- この研究成果は、MASLD/MASHの病因解明に寄与するだけでなく、治療薬の開発や、創薬スクリーニング手法の構築により、新たな予防・治療アプローチが可能となることが期待されます。
早稲田大学人間科学学術院の山田 晴也(やまだ せいや)招聘研究員、同榊原 伸一(さかきばら しんいち)教授、明治薬科大学薬学部の中舘 和彦(なかだて かずひこ)教授および群馬大学生体調節研究所の畑田 出穂(はただ いずほ)教授らによる研究グループは、肝臓の脂質代謝の調節において、Nwd1遺伝子がCa²⁺恒常性を維持し、Nwd1の欠失が肝臓内の脂肪の過剰蓄積や線維化、炎症性細胞死など実際の代謝異常関連脂肪肝炎(MASH)※1患者と同様の表現系を発症することを明らかにしました。
本研究成果は『Communications Biology』(論文名:Induction of MASH-like pathogenesis in the Nwd1−/− mouse liver)にて、2025年3月11日(火)にオンラインで掲載されました。

図1:Nwd1欠失によりCA2+恒常性が失われ、MASH様の脂肪肝炎が引き起こされる
(1)これまでの研究で分かっていたこと
肝臓は脂質代謝や解毒機能など、多様な役割を担う重要な臓器です。代謝異常関連脂肪性肝疾患(MASLD)(旧:非アルコール性脂肪性肝疾患(NAFLD))や代謝異常関連脂肪肝炎(MASH)(旧:非アルコール性脂肪肝炎(NASH)は、世界的に人口の30%の有病率が報告されています。これらは肝硬変や肝がんへと進行するリスクを伴う“重篤な疾患”として大きな注目を集めています。しかし、MASLD/MASHの発症メカニズムに関しては、その全貌が明らかとなっていません。そのため、MASHの治療に関しては、2024年3月に米国食品医薬品局(FDA)が初めて治療薬「Rezdiffra」(一般名:Resmetirom)を承認したばかりであり、治療薬は依然としてこの1つしかありません。
これまでの研究により、MASLD/MASHの発症には細胞内小器官の小胞体が密接に関与していることが示唆されてきました。小胞体は、カルシウム(Ca²⁺)の貯蔵やタンパク質の折りたたみ、脂質代謝などを担う細胞内小器官として知られ、小胞体内Ca²⁺のバランス(Ca²⁺恒常性※2)が崩れると、肝臓の脂質蓄積や炎症、線維化が進行するとされています。特に、Sarco/Endoplasmic Reticulum Ca²⁺-ATPase 2(SERCA2)は、その機能不全は小胞体ストレス※3の増加や脂質滴の形成を引き起こすことが報告されています。しかし、SERCA2の機能がどのように調節されているのか、その分子メカニズムについても未だ十分に解明されていません。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
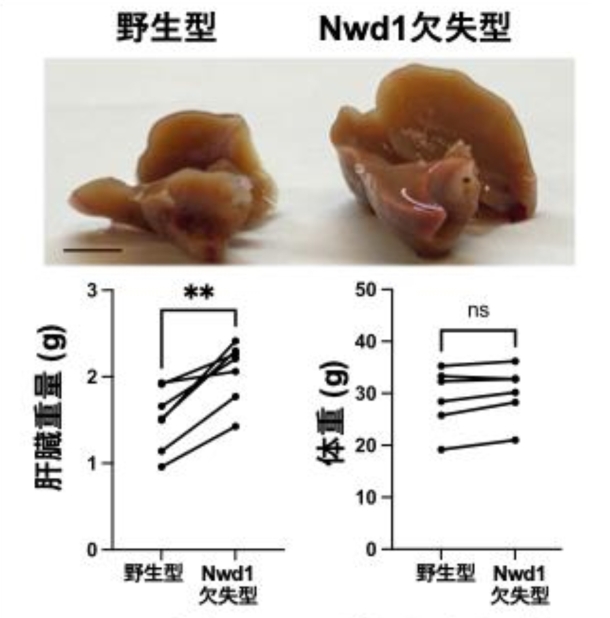
研究ではまず、研究グループが着目してきた遺伝子Nwd1を欠失させたマウスを新たに作製し、Nwd1の生体機能における役割を解明することを目指しました。Nwd1欠失型マウスの肝臓は、肉眼解剖および重量測定の結果から、野生型と比較して顕著に肥大化していることが分かりました。この肝臓の肥大の一方で、体重には大きな変化を伴わなかったため、Nwd1の欠失が肝臓に特異的な病態を引き起こしている可能性が高いと考えられます(図2)。
- 図2:Nwd1欠失により肝臓の肥大化が生じる。
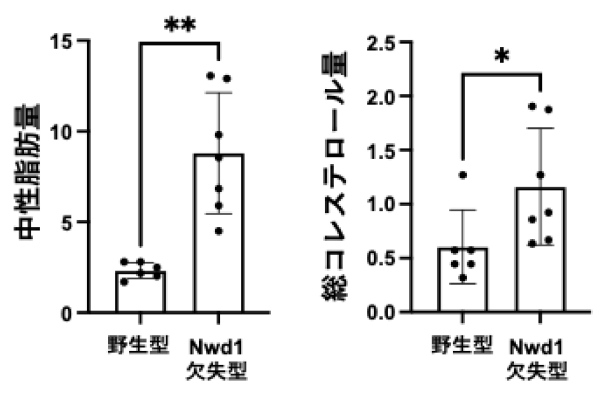
- 図3:Nwd1欠失により肝臓内に中性脂肪と総コレステロールが蓄積する。
続いて、Nwd1欠失型マウス肝臓における脂質代謝異常の可能性を調べました。その結果、組織内の中性脂肪および総コレステロール含量は、野生型マウスと比較して有意に蓄積が促進していることが分かりました(図3)。また、組織学的解析から、肝臓の肝細胞への過剰な脂質の蓄積に加え、実際のMASH患者の表現系と同様な線維化の進行や炎症性細胞死が認められました。このNwd1欠失型マウスの抹消血液中の中性脂肪や総コレステロールには大きな変化がみられなかったため、肝臓が脂質を抱え込み、排出できない状態に陥っている可能性が高いと考えられます。
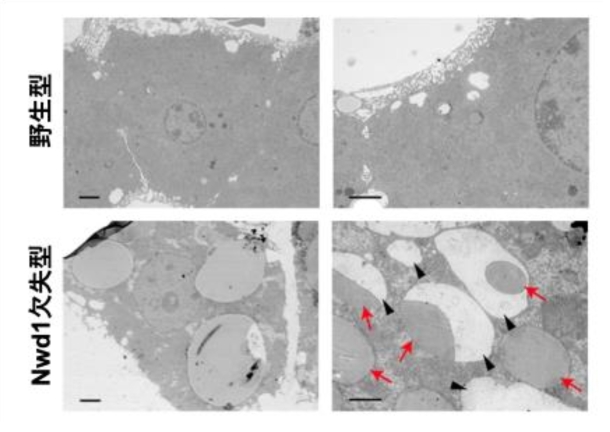
この蓄積状態をさらに詳細に検討するため、Nwd1欠失型マウス肝臓の組織像を電子顕微鏡や免疫組織化学染色で詳細に観察したところ、野生型に比べて多数の巨大な脂肪滴が形成され、小胞体由来とみられる異常な空胞構造が顕著に増加していることがわかりました(図4)。さらに、野生型では脂肪滴が類洞へと放出される様子が観察されましたが、Nwd1欠失型マウス肝臓では類洞への放出が見られなかったため、肝臓内の脂質の蓄積異常は脂質を排出できないことが原因であることが明らかになりました。
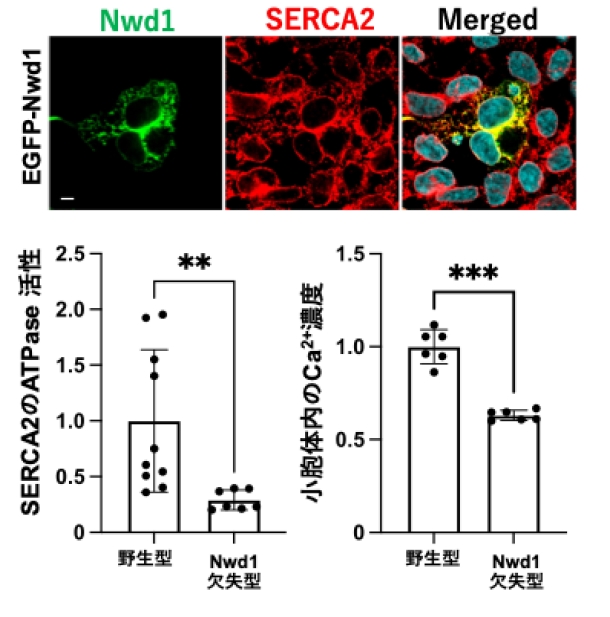
次に、これらの異常が小胞体に起因する可能性を検討しました。Nwd1がどのように小胞体機能や脂質代謝に関わっているのかを解明するため、Nwd1と相互作用するタンパク質を網羅的に探索・同定しました。その結果、Nwd1は小胞体内Ca²⁺濃度を制御するSERCA2と結合し、共に小胞体上で共局在することが明らかになりました(図5)。実際にNwd1欠失型マウスの肝臓内でSERCA2のCa2+濃度を制御する活性(ATPase活性※4)を測定すると、野生型と比較して有意に減少していました。そして、小胞体内に貯蔵されるCa²⁺においても顕著に減少しており、Nwd1とSERCA2の相互作用がCa²⁺恒常性の維持に重要であることが明らかになりました(図5)。
本研究で得られた結果から、Nwd1とSERCA2の相互作用が肝臓内のCa²⁺恒常性維持に重要であり、その破綻がMASH様の病態を誘導することが明らかになりました。
- 図4:Nwd1欠失により肝細胞内で脂肪滴(赤矢印)と異常な小胞体由来の空胞(黒矢尻)構造が形成される。
- 図5:Nwd1(緑)はSERCA2(赤)と共に局在するNwd1の欠失によりSERCA2の活性が減少し、小胞体内のCa2+濃度が減少する。グラフは野生型に対する相対値を示す。
(3)研究の波及効果や社会的影響
本研究により、Nwd1が小胞体膜上においてCa²⁺恒常性を維持し、肝細胞の脂質代謝を制御する分子基盤の一端を解明しました。また、実際のMASH患者検体の肝臓では、Nwd1遺伝子の発現量が有意に減少していることも他の研究で示唆されています。本成果は、世界的に人口の30%が発症する非アルコール性脂肪肝炎(MASLD/MASH)の病因解明に寄与するだけでなく、将来的には、Nwd1あるいはSERCA2を分子標的とするMASLD/MASHの治療薬の開発や、Nwd1/SERCA2の機能評価を組み込んだ創薬スクリーニング手法の構築により、MASLD/MASHの予防・治療に新しいアプローチがもたらされることが期待されます。
(4)今後の課題
今回、Nwd1がSERCA2と相互作用し、肝細胞における脂質代謝や小胞体ストレスを制御する重要な役割を担っていることが明らかになりましたが、Nwd1がどのようにSERCA2の構造変化やATPase活性を制御しているのかといった分子機構には依然として不明な部分が多く残されており、今後の研究課題になると考えられます。
(5)研究者のコメント
本研究は早稲田大学をはじめ、明治薬科大学や群馬大学の研究グループの協力により論文化することができました。肝臓における脂質代謝異常に関わる疾患の多くは疾患発症メカニズムや有効な治療法の確立が十分に進んでいないのが現状です。本研究によりMASHに関連する新たな知見が得られたことは、今後の基礎研究のみならず、肝疾患の新たな治療戦略や予防法の開発に向けて意義が大きいと考えております。(榊原)
(6)用語解説
※1 MASLD, MASH
MASLD(代謝機能障害関連脂肪性肝疾患((旧:非アルコール性脂肪性肝疾患(NAFLD))とMASH(代謝機能障害関連脂肪肝炎)(旧:非アルコール性脂肪肝炎(NASH))は代謝異常に関連した脂肪肝疾患の新しい名称。MASLDは脂肪肝と代謝異常を持つ状態を指し、MASHはMASLDが進行し、脂質蓄積に加えて炎症(肝炎)や線維化、細胞死を伴う病態を指す。進行すると肝硬変や肝がんを発症する。
※2 Ca²⁺恒常性
細胞内外のカルシウムイオン濃度を適切に維持する仕組み。小胞体やミトコンドリアがCa²⁺ポンプやチャネルを用いてCa²⁺濃度を調節し、異常が生じると小胞体ストレスや細胞死が引き起こされる。
※3 小胞体ストレス
小胞体内でのタンパク質の適切な折りたたみの障害や、未成熟または異常なタンパク質が蓄積することで引き起こされる細胞ストレスのこと。小胞体ストレスが持続すると炎症や細胞死を誘発し、MASLD/MASHや神経変性疾患などの病態に関与することが知られている。
※4 ATPase活性
ATPの加水分解を介してエネルギーを供給し、イオン輸送や分子モーターの駆動に重要な役割を果たす酵素(ATPase)活性。SERCA2のATPase活性は、小胞体内のCa²⁺濃度調節を担う。
(7)論文情報
雑誌名:Communications Biology
論文名:Induction of MASH-like pathogenesis in the Nwd1−/− mouse liver
執筆者名(所属機関名):山田 晴也1,2*、小川 颯1、船戸 心桜栞1、加藤 実咲1、中舘 和彦3、
水越 智也1、川上 清明3、小林 良祐4、堀居 拓郎4、畑田 出穂4,5、榊原 伸一1*
1. 早稲田稲田大学 人間科学学術院 分子神経科学研究室
2. ヘルシンキ大学生命科学研究所(HiLIFE)ニューロサイエンスセンター
3. 明治薬科大学 機能形態学研究室
4. 群馬大学 生体調節研究所 生体情報ゲノムリソースセンター ゲノム科学リソース分野
5. 群馬大学 未来先端研究機構(GIAR)、 *責任著者
掲載日時:2025年3月11日(火)10:00(GMT)、19:00(JST)
掲載URL:https://www.nature.com/articles/s42003-025-07717-5
DOI:https://doi.org/10.1038/s42003-025-07717-5
(8)研究助成
- 日本学術振興会科学研究費助成(21K20701, 山田 晴也)(23K05996, 榊原 伸一)
- 公益財団法人痛風・尿酸財団 研究助成(2020, 榊原 伸一)(2022, 山田 晴也)
- 早稲田大学特定課題(2021C-611, 2022C-611, 山田 晴也)(2022C-214, 2023C-207, 榊原 伸一)
- 創薬等先端技術支援基盤プラットフォーム―BINDS (AMED) (JP21am0101120, 畑田 出穂)