早稲田大学理工学術院の柴田重信(しばたしげのぶ)教授と池田祐子(いけだゆうこ)一貫制博士課程5年生らの研究グループは、体内時計の食事による同調において新規なメカニズムを発見しました。
体内時計と食・栄養との関係を調べる「時間栄養学」や体内時計と薬の関係を調べる「時間薬理学」など、体内時計の健康科学が発展してきたことから(参考文献)、2017年のノーベル医学・生理学賞は、「体内時計」の分野に授与されました。したがって、時間栄養学の学問的な価値が益々高まってきています。すなわち食・栄養の適切な摂取タイミングが体内時計を同調させ、生活リズム維持に重要であることが分かってきています。
従来、食事性の同調には炭水化物―インスリンが、必須のシグナル系であると考えられていましたが、本研究グループは、正常なマウスを用いて、タンパク質が豊富な食事は新規なIGF-1やグルカゴンのシグナル系を使い、食事性同調を引き起こすことを見出しました。ヒトの肥満防止や糖尿病治療には低炭水化物食が好まれていますが、この場合でも、インスリンに代わってIGF-1のシグナルで食事性同調を作りだすことが出来る可能性を提示しています。さらに、安価なアミノ酸であるシステインでも十分に食事性同調を引き起こせることを発見しました。将来的に低炭水化物食に添加するなど、糖尿病の新規な食事療法の選択肢になる可能性が示唆されます。
本研究は、食事内容や食事療法が必要な糖尿病などにおいては、従来と異なった同調系シグナルが有効であるという、ヒトや医療に応用できる発見を成し遂げました。
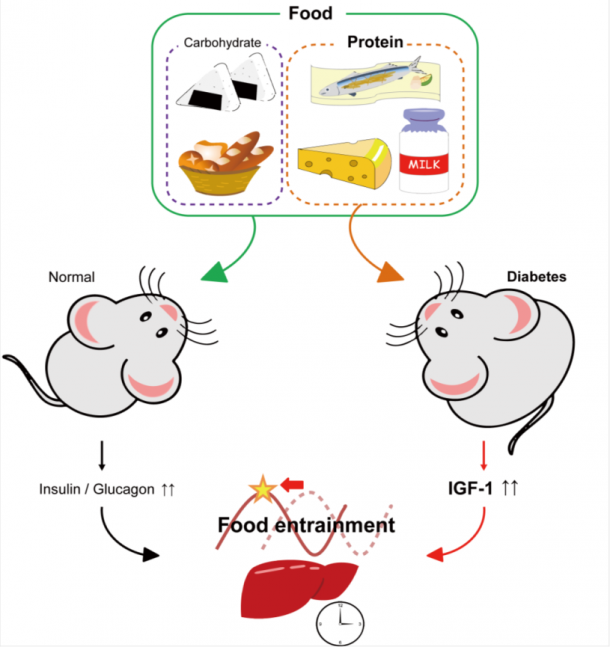
図1 表紙候補
本研究成果は、Cell PressグループとLancetグループが共同運営するオープンアクセス誌『EBioMedicine』オンライン版に2018年1月21日に掲載されました。さらに、2月号の表紙の候補にもなっており(図1)、本研究内容を解説したcommentaryも掲載されました。
(1)これまでの研究で分かっていたこと
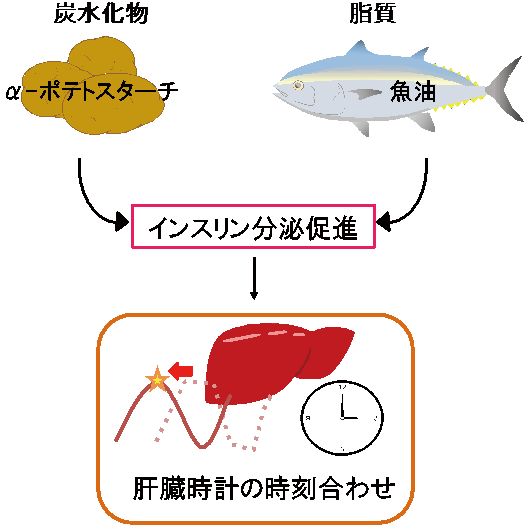
図2 炭水化物や魚油のω‐3脂肪酸がインスリン分泌を介して時計同調を促進
体内時計は視交叉上核という主時計と、末梢臓器にある末梢時計から成り立っている。体内時計は24時間よりずれており、視交叉上核の主時計は主に外界の光刺激で24時間周期に同調し、末梢時計は食事刺激で同調することが知られている。食事による同調のメカニズムは、血糖上昇にともなうインスリンの分泌とその後の細胞内シグナルによることが知られている(図2)。しかしながら1型糖尿病モデルマウスでは、インスリン分泌は起こらないにも関わらず、食事性の同調は十分に観察される。このようにインスリンの働きが低下する2型糖尿病、あるいはインスリンの分泌がない1型糖尿病では、食事性の同調が実際どのように行われているか、興味がある点である。つまり、インスリンを介する同調以外のシグナル系が存在する可能性が強く示唆されていた。
(2)今回の研究で新たに明らかになったこと
正常なマウスに100%タンパク質の餌を与えると炭水化物が豊富な餌に比較すると作用は弱めであるが、有意な十分な食事性同調が起こることが分かった。この同調時に、インスリンレベルの上昇は確認されなかったが、血中や肝臓でIGF-1(IGF-1: insulin-like growth factor-1; インシュリン様成長因子-1)やグルカゴンの上昇が見られた。したがって、タンパク質が豊富な食事では、IGF-1やグルカゴンがインスリンに代わって、同調シグナルになっていた。IGF-1受容体の拮抗薬でこれらの作用はブロックされ、IGF-1をインビトロ・インビボの系で投与すると末梢時計の同調が見られた(図3)。1型糖尿病モデルマウスに高タンパク質食を与えると食事性同調が起こり、IGF-1の増大も確認できた(図4)。次にタンパク質の分解産物のアミノ酸に着目した研究を行った。20種類のアミノ酸の中で、システインがIGF-1の上昇を伴いより強力な同調作用を引き起こした(図5)。
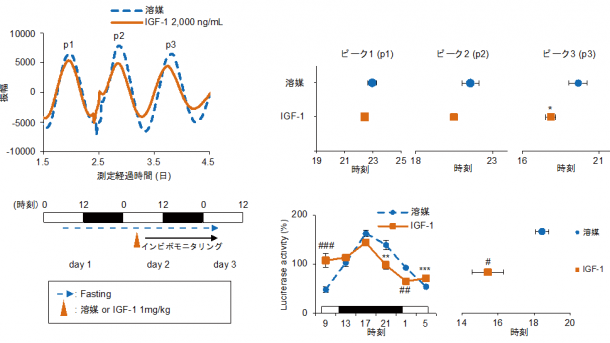
図3 IGF-1を、細胞に投与しても位相が前進、マウスに与え肝臓をモニターしても位相が前進する

図4 糖尿病マウスでもタンパク質食はIGF-1を増加させ体内時計を同調させる

図5 システインの投与はIGF-1を増大させ、体内時計を同調させる
(3)今回の研究で得られた結果及び知見
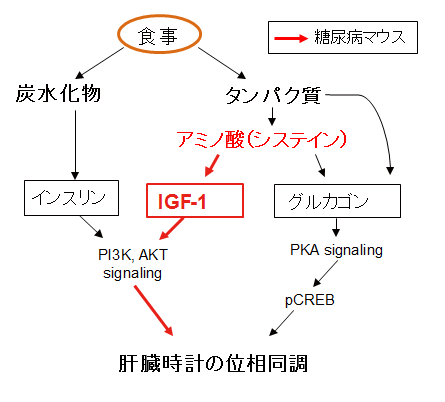
図6 今回の研究成果を加えた模式図
今回の研究から、タンパク質が豊富な食事は新規なIGF-1やグルカゴンのシグナル系を使い、食事性同調を引き起こすことを見出した。肥満防止や糖尿病治療には低炭水化物食が好まれているが、この場合でも、インスリンに代わってIGF-1のシグナルで食事性同調を作りだすことが出来る可能性を提示できた。さらに、安価なアミノ酸であるシステインでも十分に食事性同調を引き起こせたので、将来的に低炭水化物食に添加するなど、糖尿病の新規な食事療法の選択肢になる可能性が示唆された。これまでの知見と今回の知見を合わせた模式図を図6に示す。
(4)研究の波及効果や社会的影響
今回の研究成果は、ヒトへの応用の橋渡しになる研究成果である。実際、朝食による同調は損なわずに食後高血糖を避けるために高炭水化物食ではなく高タンパク質食を勧める本研究成果は、臨床における2型糖尿病での朝食の食事療法と類似している。また、American Diabetes Association (ADA) や National Health Service UK (NHS UK)は、現在 50-55 グラムのタンパク質を健常者・糖尿病者に推奨しており、これは-総エネルギーの15–20%をタンパク質から取ることになり、本研究の成果とも合致する。システインは医薬品としてばかりでなく、安価な食材としても利用されているので、ヒトを対象とした臨床試験も大いに期待できる。
(5)今後の課題
本研究はマウスのデータであり、この成果をもとにヒトの介入試験等を早々に進め、マウスの知見を実証する必要がある。また、1型のみならず2型糖尿病モデルマウスを用いて、今回の研究結果を確認する必要がある。今回はシステインのみ候補としたが、アミノ酸も組み合わせによっては、より強力な作用が見いだせる可能性があり、そのような研究も進める必要がある。
(6)100字程度の概要
末梢時計はインスリンのシグナルを利用して食事性の同調を起こすことが知られていたが、糖尿病などでインスリンシグナルが使えないときにタンパク質やシステインが豊富な食事によるIGF-1が同調に働くことが分かった。
参考文献
(1)Tahara Y and Shibata S, Nat Rev Gastroenterol Hepatol. 2016
(2)Vetter C and Scheer FA, Curr Biol. 2017
論文情報
- 掲載誌: EbioMedicine
- 論文名:Glucagon and/or IGF-1 production regulates resetting of the liver circadian clock in response to a protein or amino acid-only diet
- 著者: Yuko Ikeda, Mayo Kamagata, Mizuho Hirao, Shinnosuke Yasuda, Shiho Iwami, Hiroyuki Sasaki, Miku Tsubosaka, Yuta Hattori, Ai Todoh, Konomi Tamura, Kazuto Shiga, Teiji Ohtsu and Shigenobu Shibata
- DOI: doi:10.1016/j.ebiom.2018.01.012
- Commentary の記事:Protein-rich or amino-acid only diets entrain the liver CLOCK: time to scrap insulin? Andrea Maugeri, Jude A. Oben, Manlio Vinciguerra
※本研究(の一部)は、内閣府戦略的イノベーション創造プログラム(SIP)「次世代農林水産業創造技術」(管理法人:生研支援センター)によって実施されました。









