正常な神経細胞分化、鍵はタンパク質凝集
~ATRXの相分離が担う脳の発達と病態形成~
ポイント
- 知的障害や脳発達異常の原因遺伝子ATRXが、脳細胞の運命を決める新たな仕組みを発見。
- ATRXが核内に「凝集体(液滴)」を作り、これが神経細胞の正常な分化を促進することを解明。
- 凝集体形成が阻害されると神経細胞への分化過程が正しく進まず、神経管構造の異常など脳発達に重大な影響を及ぼすことを示唆。
- ATRXの変異によって引き起こされる発達障害(ATR-X症候群)や膠芽腫などのがんの病態解明、さらには新たな治療法の開発につながることが期待される成果。
概要
脳の発達や神経細胞が正しく分化する仕組みは、多くの謎に包まれています。早稲田大学、東京医科大学、および慶應義塾大学の研究グループは、クロマチン※1リモデリング因子として知られるATRX※2が、核内で液-液相分離※3(LLPS)と呼ばれる機構を介して「凝集体(液滴)」を形成し、これが神経細胞の分化を促す重要な役割を担っていることを初めて明らかにしました。本研究は、早稲田大学人間科学学術院の友岡 領(ともおか りょう)研究助手、神山 淳(こうやま じゅん)教授、東京医科大学薬理分野の金蔵孝介(かねくら こうすけ)教授、 慶應義塾大学再生医療リサーチセンターの岡野栄之(おかの ひでゆき)センター長/教授を中心とした研究グループによる成果です。
研究チームは、ATRXがLLPSによって核内に反応の場を作り出し、神経分化※4に必要な遺伝子の発現を調節していることを示しました。これにより、神経分化機構にATRXがどのように関与しているのか、その過程が明らかになりました。本研究成果は、ATRXの変異によって引き起こされる発達障害(ATR-X症候群)や悪性の脳腫瘍である膠芽腫の病態解明や新規治療法の開発の新たな道を拓くと期待されます。
本研究成果は、2025年7月14日にNature(英国)系の科学雑誌『Nature Communications』に掲載されました。
キーワード
ATRX、液-液相分離(LLPS: Liquid-Liquid phase separation)、神経幹細胞、細胞運命決定
これまでの研究で分かっていたこと
ATRXは、核内でDNAの構造を安定化させるクロマチンリモデリング因子として知られています。クロマチンリモデリングとは、DNAとヒストンタンパク質からなるクロマチンの構造を変化させることで、遺伝子の発現を制御する仕組みです。このATRXに変異が生じると、神経発達障害やがんの発症と関連することが報告されており、神経分化においても重要な役割を担っていると考えられています。
これまでの研究では、ATRXが主に遺伝子発現が抑制されたヘテロクロマチン領域に集積することに注目が集まり、特にセントロメアやテロメアといった領域での機能が解析されてきましたが、主にモデル動物でもあるマウスを対象とした研究が中心でした。
また、ATRXが神経分化の過程にどのように関与しているのか、その詳細はまだ十分に解明されていませんでした。その背景には、ヒトとマウスの間に存在する種差や、ATRXが遺伝子発現の活発な領域(ユークロマチン)に与える影響についての研究が不足していることが挙げられます。
そこで本研究では、ヒトのiPS細胞由来神経系細胞を用いて、これまで十分に評価されてこなかったATRXの新たな機能を明らかにすることを目指しました。
今回の新たに実現しようとしたこと、明らかになったこと、そのために新しく開発した手法
- ATRXの相分離能の評価
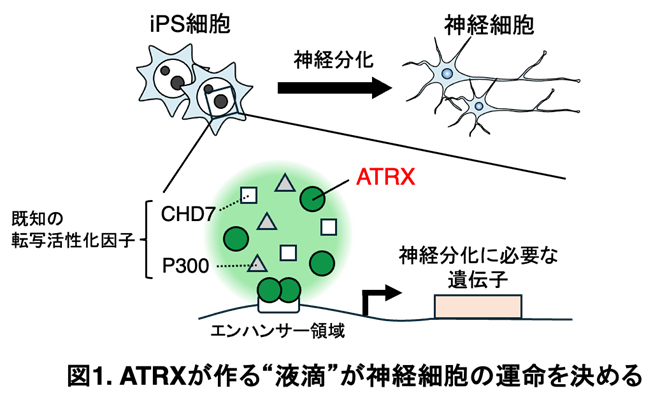
本研究では、ヒト神経前駆細胞において、ATRXタンパク質が核内に液-液相分離(LLPS)による凝集体を形成することを見出しました。ATRXは大きな天然変性領域※5(IDR)を持つことから、細胞内で膜を持たない構造体(コンデンセート)を形成する可能性があると考えました。
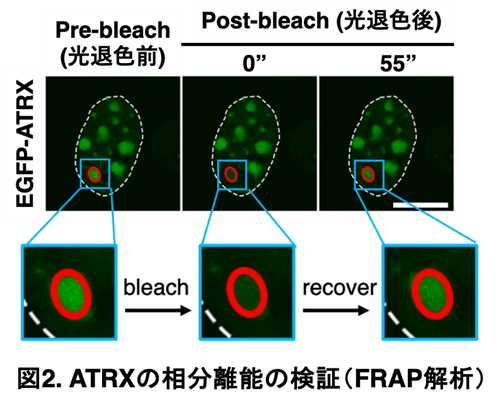
ATRXに蛍光タンパク質EGFPを融合させた細胞でFRAP解析※6を行った結果、形成された凝集体は分子が出入り可能な流動性を持ち、LLPSによる構造体であることを確認しました(図2参照)。
- ATRXは相分離を介して遺伝子発現を調節する
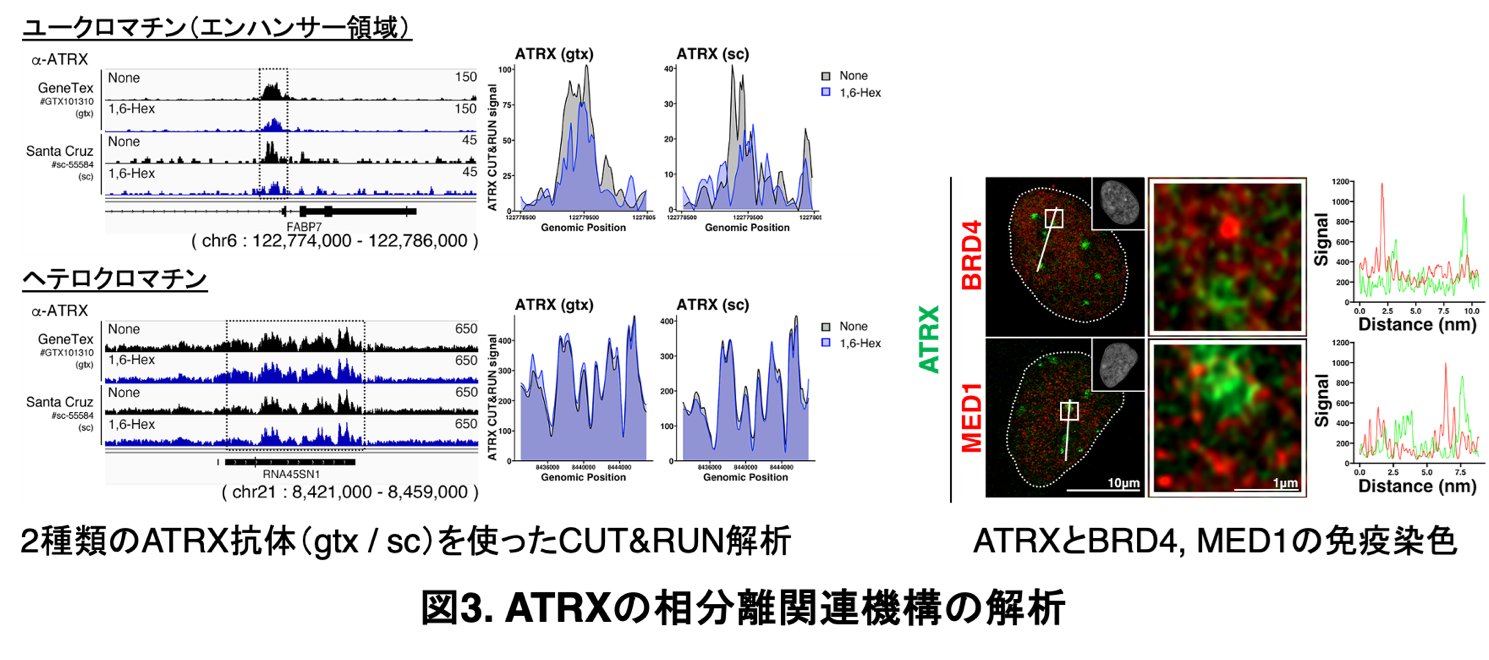
次に、ATRXがどのようなクロマチン状態と関係するかを調べました。LLPS構造体は、遺伝子発現が活発なユークロマチン領域(エンハンサー領域)に形成されていることが確認されました。
ヒト神経前駆細胞において、CUT&RUN※7法を用いて解析したところ、ATRXはユークロマチン上に特異的に結合しており、その結合はLLPS阻害剤1,6-Hexanediol※8の処理により減少することが分かりました。これにより、ATRXがLLPSを介してユークロマチンに結合していることが明らかになりました。一方で、ヘテロクロマチン領域に対するATRXの結合には1,6-Hexanediolの影響が見られず、LLPSとは独立した機構による結合であると考えられました(図3左参照)。
さらに、エンハンサー領域でLLPS構造を形成することで知られる転写活性化因子※9BRD4やMED1とは異なり、ATRXはそれらとは独立に凝集体を形成していることも示されました(図3右参照)。
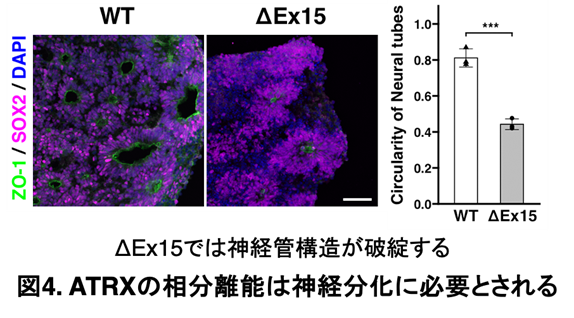
- ATRXの相分離能は神経分化に必要とされる
最後に、ATRXのIDRの中でもグルタミン酸が高密度に存在する「poly-E領域」が、凝集体の形成に必須であることを明らかにしました。ゲノム編集※10により、このpoly-E領域をコードするExon15をCRISPR/Cas9で欠損させた変異体(ΔEx15)では、ATRXの核内凝集体が形成されなくなりました。
さらに、オルガノイドを用いた免疫染色の結果、ΔEx15では神経管様構造の形成が阻害され、神経分化が正常に進行しないことが確認されました(図4参照)。ここでは、ZO-1シグナル(緑色)を中心にSOX1陽性細胞(紫色)が環状に集積する構造を神経管様構造として評価しており、これらのマーカーが陰性の場合はDAPIによる核染色(青色)のみが観察されます。
本研究により、ATRXがLLPSを介してユークロマチン上で遺伝子発現制御に関わり、神経分化を支えているという新たなメカニズムが明らかになりました。
研究の波及効果や社会的影響
本研究により、ATRXが液-液相分離(LLPS)を介してユークロマチン領域で機能するという新たなメカニズムが明らかになりました。これまでATRXは主にヘテロクロマチンの制御やゲノム安定性の維持に関与する因子とされてきましたが、本研究は、これまで想定されていなかった転写活性化領域での機能を示した初の成果です。
この知見は、ATRXの機能的多様性を理解する上で大きな前進であり、これまで十分に説明できなかった神経発達障害や腫瘍への関与を解明する手がかりとなる可能性があります。今後、ATRXを介した遺伝子制御の破綻が、さまざまな疾患の発症にどのように関与するのかを探る研究が進むことが期待されます。また、ATRX凝集体形成を標的とした新たな治療法開発の可能性も拓けます。
今後の課題、展望
今後は、ATRX凝集体形成の制御メカニズムをより詳細に解析し、他の脳疾患への関与や応用可能性を探る必要があります。また、凝集体形成を制御する薬剤開発など臨床応用を視野に入れた研究を進めることも重要です。
研究者のコメント
よく知られた遺伝子でも、異なる視点から見ることで、これまで気づかれなかった性質が見えてきます。今回の発見のような核内の小さな変化が、病気という大きな違いにつながる仕組みを、今後さらに解き明かしていきたいと考えています。
用語解説
※1 クロマチン
DNAとヒストンというタンパク質が結びついた構造で、細胞の核の中にあります。遺伝子が使われやすい「ユークロマチン(開いた構造)」と、使われにくい「ヘテロクロマチン(閉じた構造)」があり、細胞はこれらを使い分けて遺伝子の働きを調整しています。特に、染色体の中央付近にあるセントロメアや末端に位置するテロメアは、ヘテロクロマチンの代表的な構造であり、染色体の安定性維持や分配に重要な役割を果たします。
※2 ATRX (Alpha-thalassemia/mental retardation syndrome X-linked)
ATRXは、精神発達障害を主な症状とするATRX症候群の原因遺伝子として同定されたX染色体上の遺伝子で、核内でDNAの構造を調節するクロマチンリモデリング因子をコードしています。このタンパク質は、ヘテロクロマチン領域に結合し、遺伝子発現の制御や染色体の安定維持に関与することが知られています。さらにATRXは、膠芽腫などの悪性脳腫瘍においてもしばしば変異が認められ、がんの進展との関係も考えられています。
※3 液-液相分離(Liquid-Liquid Phase Separation)
細胞内でタンパク質やRNAが集まり、油と水のように自然に分かれて、膜のない液滴状の構造をつくる現象です。分子を一時的に集中・分離させることで、細胞内の反応や情報の調整に関与します。このしくみは、ストレス顆粒や核小体など多くの細胞構造の形成に関係しており、最近では神経変性疾患などとの関連も注目されています。
※4 神経分化
未分化な細胞(神経幹細胞など)が、神経細胞やグリア細胞など、脳や神経系のはたらきを担う専門的な細胞に変わっていく過程です。発達や再生医療、神経疾患の研究にとって重要な現象です。
※5 天然変性領域(IDR: Intrinsically Disordered Region)
決まった立体構造をとらず、柔軟で動きやすい性質をもつタンパク質の一部です。IDRは、他の分子とのゆるやかな相互作用を繰り返し行う能力があり、液-液相分離のような動的な構造形成に大きく関与します。また、IDRは細胞内の環境や修飾によってその性質が変わるため、機能の調節にも関わる重要な領域です。
※6 FRAP (Fluorescence recovery after photobleaching) 解析
FRAP解析は、細胞内のタンパク質や分子の動きを調べる手法です。蛍光で標識した分子に強いレーザーを照射して一部を“光退色”(蛍光を消す)させ、その後に周囲からどれくらい早く蛍光が回復するかを観察することで、分子の拡散性や可動性を評価できます。タンパク質が細胞内で、液-液相分離の性質を持つかどうか(液体のように分子の出入りがあるかどうか)を見分けるのに用いられます。
※7 CUT&RUN
特定のタンパク質がDNAのどの領域に結合しているかを高精度で調べる実験手法です。抗体を使ってターゲットとなるタンパク質を認識し、それに結合した酵素(ヌクレアーゼ)が周辺のDNAを切断します。その切断断片を回収・解析することで、染色体上でのタンパク質の結合位置を特定できます。クロマチン構造や転写制御の研究で広く用いられています。
※8 1,6-Hexanediol
液-液相分離(LLPS)の実験で用いられる化合物で、分子間のゆるやかな相互作用を一時的に阻害します。これにより、LLPSによって形成された液滴構造(凝集体)を可逆的に分解できるため、その形成メカニズムや生理的意義を調べる際に有効です。細胞機能やタンパク質の局在変化を観察するためのツールとして利用されます。
※9 転写活性化因子(BRD4, MED1, P300, CHD7)
これらは、遺伝子の転写(mRNA合成)を促進する因子として知られています。BRD4とMED1、P300は、液-液相分離(LLPS)によって膜のない凝集体を形成することで、RNAポリメラーゼなどの因子を効率的に集め、遺伝子発現を促進することが報告されています。一方、CHD7は、ATRXと同様に神経前駆細胞の性質を維持するうえで重要な役割を持つことが報告されています。
※10 ゲノム編集 (Exon, CRISPR/cas9)
ゲノム編集は、DNAの特定の部分を狙って切断・改変する技術で、遺伝子の機能を調べたり制御したりするために用いられます。代表的な手法であるCRISPR/Cas9は、細菌の免疫機構を応用したもので、特定のDNA配列を切断・修復することで、狙った遺伝子領域を削除・置換・挿入することができます。高い精度と操作の容易さから、現在では生命科学研究に広く使われています。エクソン(Exon)は、遺伝子の中で実際にタンパク質の設計図となる情報が含まれている部分で、複数のエクソンが連結されて1つのタンパク質が合成されます。その配列や構造の変化は、タンパク質の機能に直接影響を与えることがあります。本研究では、CRISPR/Cas9を用いて、ATRX遺伝子のExon15(15番目のエクソン)を特異的に欠損させました。この改変により、ATRXの凝集体形成や神経分化への影響を解析しました。
論文情報
雑誌名:Nature Communications
論文名:Phase Separated Condensates of ATRX Regulate Neural Progenitor Identity
執筆者名(所属機関名):友岡領(早稲田大学)、佐野坂司(慶應義塾大学)、宮城碧水(東京医科大学)、安藤(野田)友子(早稲田大学)、坂野聡重(早稲田大学)、溝田紀子(早稲田大学)、金蔵孝介(東京医科大学)、岡野栄之(慶應義塾大学)、神山淳*(早稲田大学)
掲載日時:2025年7月14日(月)
DOI:https://doi.org/10.1038/s41467-025-61881-0
掲載URL:https://www.nature.com/articles/s41467-025-61881-0
研究助成
本研究は、JSPS科研費JP19H03623, JP24K02571、日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム(技術開発個別課題)、「iPS細胞由来神経前駆細胞を『高品質化』する手法の開発」、再生医療等実用化研究事業「中枢神経系に対する再生医療の普及に資する細胞製剤作製技術の確立」の支援により実施されました。