人工細胞を造ることにより生命を成立させている条件が見えてきました。

理工学術院 助教 宮﨑 牧人(みやざき・まきと)
1983年東京都生まれ。2006年早稲田大学理工学部卒業。2008年同大学院理工学研究科修士課程修了。2011年京都大学理学研究科博士課程修了。日本学術振興会特別研究員(DC1)、早稲田大学先進理工学部次席研究員を経て現職。博士(理学)。専門は生物物理学。
トップダウンからボトムアップ・アプローチへ。細胞をパーツ化し組み立てることで生物に必須な基本的特徴の解明が進んでいます。
今から50年ほど前の1968年、電子顕微鏡の観察により細胞の赤道面に「収縮環」が発見され、その後の一連の研究により、主な成分はタンパク質のアクチンとミオシンであることが明らかになりました。ご存じのとおり全ての生物は細胞から成り、細胞分裂によって成長、増殖します。収縮環は、細胞が分裂する時だけ現れるリング状の構造で、それが巾着の口を閉じるように収縮することで細胞膜がくびれ、最後は二つにちぎれて分裂するのです。しかし、収縮環が形成される肝心の仕組みについては、これまで多くの生物学者らが頭を悩ませてきました。
細胞内では、活動状況に応じて数千から数万種類もの多種多様なタンパク質が相互作用しながら機能しています。その中で、収縮環形成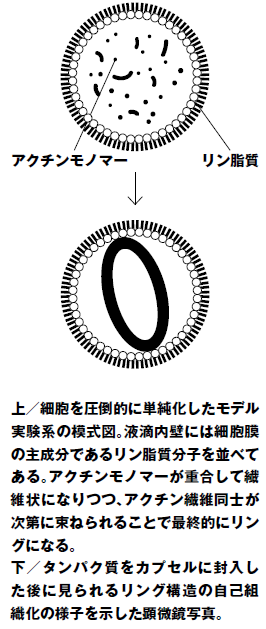 に関与しているタンパク質はどれなのか、それを網羅的ゲノム解析と遺伝子スクリーニングによって解明しようとする全体論的なトップダウン・アプローチが長らく研究の主流でした。これらの先行研究から、収縮環の形成には数十種類のタンパク質が関与していることが示唆されてきました。けれども、パーツである個々のタンパク質がどのように組み立てられ機能しているのか、もっと言えば、生命が自律的に秩序を生み出す仕組みの解明には限界がありました。そこで、私たちの研究グループでは、物質的基盤の上に生命機能を再構成したり設計したりするボトムアップ・アプローチを試みています。この手法は、「収縮環」の発見に先立つ1959年に開催された米国物理学会で、のちにノーベル物理学賞を受賞したリチャード・P・ファインマン博士が提唱した、「物質を削って機械を作る」のではなく「原子を一つずつ積み上げて機械を作る」というボトムアップ法に端を発するものです。
に関与しているタンパク質はどれなのか、それを網羅的ゲノム解析と遺伝子スクリーニングによって解明しようとする全体論的なトップダウン・アプローチが長らく研究の主流でした。これらの先行研究から、収縮環の形成には数十種類のタンパク質が関与していることが示唆されてきました。けれども、パーツである個々のタンパク質がどのように組み立てられ機能しているのか、もっと言えば、生命が自律的に秩序を生み出す仕組みの解明には限界がありました。そこで、私たちの研究グループでは、物質的基盤の上に生命機能を再構成したり設計したりするボトムアップ・アプローチを試みています。この手法は、「収縮環」の発見に先立つ1959年に開催された米国物理学会で、のちにノーベル物理学賞を受賞したリチャード・P・ファインマン博士が提唱した、「物質を削って機械を作る」のではなく「原子を一つずつ積み上げて機械を作る」というボトムアップ法に端を発するものです。
私たちが開発した手法は、人工的に作った脂質のカプセルに細胞から単離したタンパク質を封入した人工細胞で、収縮環が形成される最小限の必要条件を探る方法です。つまり細胞をいったんばらばらに分解し、分解したパーツを組み合わせて細胞機能が回復する条件を探ろうというものです。この実験の結果、アクチン・ミオシン・アクチン繊維の束化因子の3種類のタンパク質と、20μm(1μm=1000分の1mm)以下のカプセルという物理的条件下で、リングが形成され自然に収縮する様子が確認されました。実際の細胞もおおよそ10 ~ 20μmですから、細胞の中で、曲がりにくい性質のアクチン繊維が屈曲率の一番小さい赤道上に集まり束化することで収縮環が形成されると考えられます。リング形成に必要な最小構成要素のみならず、自律的に組み上がる仕組みも同時に解明できたのですが、それは従来のトップダウン・アプローチでは、難しかったと思います。
今回の解明は細胞分裂の仕組みの一端に過ぎません。これまでの通説より非常に単純なパーツの組み合わせでもリングが形成されるならば、先に述べた数十種類のタンパク質はそこにどう関与しているのでしょうか。生物は、高度に調和の取れたシステムであるという事実と向き合い、ボトムアップ・アプローチを用いて一つずつ明らかにしていくことが今後の課題です。これらは基礎研究にあたりますが、細胞分裂の仕組みの全容を明らかにできれば、がん治療や再生医療といった医療への貢献が期待されます。工学的な分野では、人工細胞によるドラッグデリバリーシステムや、人工細胞を組織とした柔らかいロボットを作ることができるかもしれません。
また、私たちは細胞分裂だけではなく、細胞運動の仕組みについても明らかにするため、自律的に動き回る人工細胞の作成にも挑戦しています。人間の細胞のメカニズムを包括的に理解し、研究成果を技術の進歩に役立ててもらえるよう、医療や工学などの分野の専門家にもアプローチしていきたいと考えています。
(『新鐘』No.82掲載記事より)








