活動紹介
1.葛西周講師の研究活動紹介
2021年10月11日~21日に行われた早稲田大学の多種多様な文化・芸術を発信するフェスティバル「早稲田文化芸術週間」にて、当研究所研究者の企画により研究内容を紹介するイベントを開催しました。企画者である葛西周講師の報告をお伝えします。
毎秋恒例の全学イベント「早稲田文化芸術週間」において、「高等研究所若手研究者企画」として研究所員の研究を広く紹介する機会が設けられることになり、今年度の企画担当を拝命しました。予備知識のない学生や一般の方々もわかりやすく楽しめる内容に、との依頼でしたので、温泉地での音楽体験に関する研究を進めていることから、温泉地で活躍するパフォーマーの方々をお招きし、実演を交えたトークイベントを企画しました。
ゲストとしてご参加いただいたのは、少女歌劇の鞍馬みしろ氏と、大衆演劇の橘大五郎氏です。鞍馬氏はOSK日本歌劇団のご出身で、現在は和倉温泉の老舗旅館・加賀屋専属の雪月花歌劇団でトップ男役を務めていらっしゃいます。橘氏は橘菊太郎劇団三代目座長・九州演劇協会会長で、特に女形として定評がおありです。少女歌劇と大衆演劇は、いずれも温泉地で発展してきた芸能ですが、それぞれ上演会場や形式がある程度固定されており、共演機会は滅多にありません。通常は昼夜舞台に出演されているお二人を揃ってお招きする本企画は、コロナ禍だからこそ実現できたとも言えます。
トークに先立つミニレクチャーでは、温泉地でどれほど多様な芸能が披露されているか紹介した上で、場所の性質上、初見の観客やたまたま居合わせて成り行きで鑑賞する観客も多いこと、ゆえにバラエティに富んだ短いパートを組み合わせたレビュー形式を取りがちであることを解説しました。続くトークでは、そのような温泉地ならではのジャンルを越えた共通点が、レパートリーや舞台機構、演出方法等にも多々見られることが具体的に裏付けられました。パフォーマーのライフコースやルーティーン、異性を演じる際のスタンスやテクニックといったトピックについてお二人から同時に伺うことで、今まで見えてこなかったジャンル間の類似性や差異がより鮮明になり、研究プロジェクトにとっても有益な質的データが得られました。さらに、鞍馬氏に《栄光の架橋》の歌劇バージョンを、橘氏に《風の盆恋歌》に合わせた女形の舞踊を実演していただけたことも、観客に耳馴染みの良い選曲や飽きさせない構成といった、トークで言及されたパフォーマンスの特性をその場で体感する絶好の機会となりました。こうした異なるジャンル間、パフォーマー間の橋渡しをするようなイベントは、ジャンル横断的な音楽・芸能論の研究成果を現場に還元するためにも、今後も継続していきたい所存です。
なお、本イベントは2021年10月12日に早稲田キャンパス小野記念講堂で催され、感染予防対策を遵守した上で一般公開されるとともに、リアルタイムでオンライン配信されて、計105名(会場46名・配信59名)に視聴いただきました。アーカイヴ配信の視聴回数は、公開約1ヶ月で1,500回に達しています。アーカイヴ映像は、引き続き高等研究所公式YouTubeでご覧いただけます。
https://www.youtube.com/watch?v=P94adtgObKw (日本語・英語字幕あり)



2.丸山剛准教授の研究成果紹介
丸山剛准教授の予防的に発がんを抑制するメカニズムについての研究成果が、「Nature Immunology」(2021年10月25日掲載)に発表されました。最新の研究についてご紹介します。
「上皮細胞によるがん変異細胞のMHC-I認識とその排除」 丸山剛准教授
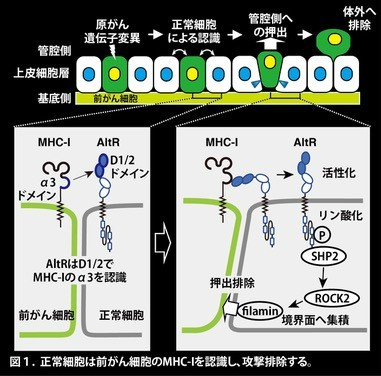
肺や腸などの表層を構成する非免疫細胞である上皮細胞には「細胞競合」という、がんの種となる前がん細胞を排除する、免疫監視に似た機能を持っています。これまで、上皮細胞は、前がん細胞の何をどのようにして認識し、攻撃しているかについては不明でした。丸山准教授は、上皮細胞は前がん細胞のMHC-Iを認識することで、攻撃するという免疫学的なリガンド(MHC-I)-受容体(AltR)システムが上皮細胞の監視システムの実態であることを報告しました(図1左下)。これまでMHC-Iは、免疫細胞が認識し、攻撃することがコンセンサスでしたが、上皮細胞もMHC-Iを認識し、攻撃できることが分かりました。
(1)これまでの研究で分かっていたこと(科学史的・歴史的な背景など)
哺乳類では、上皮細胞は、がん変異を生じた細胞(前がん細胞)を攻撃し、これを体外へ排除することができます(細胞競合)。正常な上皮細胞は前がん細胞に接触することでプライミング(活性化)され、前がん細胞に向かって細胞骨格形成因子を集積させることで、上皮細胞層から押し出すことがわかっていました。しかしながら、プライミングされた上皮細胞がどのようなリガンド・受容体相互作用*2を介して、前がん細胞を認識しているかについては不明でした。
(2)今回の研究で新たに明らかになったこと
丸山准教授は、前がん細胞を認識するプライミングされた上皮細胞の受容体を明らかにするために、機能が解明されていない免疫グロブリン(Ig)様ドメイン-タンパク質を同定し、これをCanis suboptimal alteration recognizing protein(Canis AltR)と名付けました。このタンパク質は、前がん細胞に接することでプライミングされた正常細胞で発現が増加します(図1左下)。
一方で、前がん細胞ではRasV12タンパク質*3の発現によって、MHC-Iの発現が促進することが報告されています。Ig様ドメインはMHC-Iと結合する可能性のあるドメインとされているため、正常細胞のAltRは前がん細胞のMHC-Iに結合する、すなわち上皮細胞はAltRによって前がん細胞のMHC-Iを認識しているのではないかという仮説を立てました。
in vitroの細胞競合モデル*4では、正常上皮細胞上のAltRが、前がん細胞で発現するMHC-Iによってリン酸化されます。リン酸化により活性化したAltRは下流のSHP2-ROCK2シグナル経路を介して細胞骨格形成因子filaminを前がん細胞との境界面に集積させます。これにより、前がん細胞を押し出す力を誘発します(図1右下)。
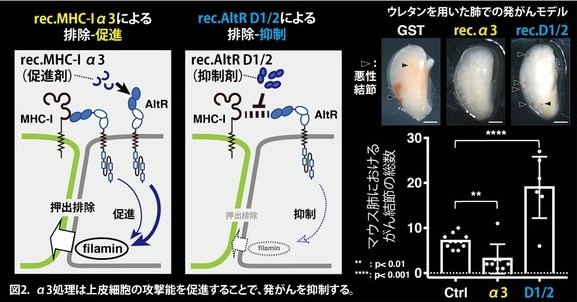
さらにMHC-IとAltR の結合領域を絞り込むことで、MHC-Iの細胞外ドメインであるα3ドメインとAltRの細胞外ドメインであるD1/2ドメインが相互作用しました。非常に興味深いことに、MHC-I α3ドメインのリコンビナントタンパク質*5(rec.MHC-I α3)のin vitro細胞競合モデルにおける培養細胞への投与は、正常細胞の攻撃能を促進することで、前がん細胞の排除を促進することを見出しました(図2左、イラスト)。一方で、AltRのD1/2ドメインのリコンビナントタンパク質*5(rec.AltR D1/2)は、上皮細胞の攻撃能を抑制しました(図2中央、イラスト)。
またさらに、in vivoマウスモデル*6における腫瘍形成と発がんにおいては、rec.MHC-I α3の投与は悪性結節*7の形成を抑制しました(図2右、ウレタン発がんモデル)。これは、rec.MHC-I α3の投与によって、上皮細胞の排除機能が促進され、前がん細胞が排除されたことで、悪性結節の形成が抑制されたこと示唆しています。加えて、rec.AltR D1/2の投与では前がん細胞の排除が抑制された結果、悪性結節の形成が促進されました。これらのことから、前がん細胞のMHC-Iを上皮細胞が認識することで、上皮細胞が前がん細胞を排除し、発がんが抑制されていることが示唆されました。
このように、非免疫細胞である上皮細胞が、前がん細胞のMHC-Iを、AltRを介して認識するという免疫細胞様の監視システムがあることを示しました。この監視システムを元にした上皮細胞による前がん細胞の排除が、発がんを抑制するメカニズムであることが明らかとなってきました。
(3)今後について
今回解明された機構を基にして得られたrec. MHC-I α3タンパク質は、マウスにおいて発がんを抑制することを見出しています。将来的には、がんを予防的に治療するための革新的な医療へとつながる可能性が期待されます。
本研究を基にしたがんの予防的な治療法が確立されることが期待されますが、前がん細胞は検出することが非常に難しいです。そのため、前がん細胞を検出する技術の開発が今後の課題であり、この検出技術の発展により、rec.MHC-I α3などを基にした治療薬が活躍すると考えられます。
バクテリアやウイルスなどの感染症では、感染をワクチンにより予防し、感染者を薬で治療するというスキームが一般的になっています。がんにおいては、発症後のがん治療は一般的ですが、がんを予防するという概念はあまり社会に浸透していません。本研究により、がんを予防する治療に社会が注目し、がんにならない社会が実現できることを期待しています。
(4)用語解説
*1 MHC-I
MHC-I(Major Histocompatibility Complex class I)は細胞内のタンパク質を抗原として細胞外に提示する細胞膜タンパク質で、さまざまな細胞の表面に発現することで、一般的に免疫細胞にシグナルを発信するリガンド(特定の受容体に特異的に結合する物質)として働く。異常を持つ細胞ではMHC-Iを積極的に発現させることで、自身が異常細胞であることを免疫細胞に伝える役割を果たしている。
*2 リガンド(MHC-I)-受容体(AltR)
リガンド-受容体相互作用は、タンパク質同士の相互作用の一つで、多くの場合リガンドがそれを受容するタンパク質(受容体)に結合することで、その受容体を発現する細胞の特定の機能や細胞内シグナルなどを有効化する。AltR(suboptimal alteration recognizing protein)はMHC-Iと相互作用しうるIg様ドメインを持つタンパク質(細胞膜タンパク質受容体)であるが、その機能は解明されていなかった。今回、上皮細胞は前がん細胞と接触することで、この受容体(AltR)の発現量を上昇させ、膜タンパク質リガンドであるMHC-Iのシグナルを受容することを明らかにすることができた。さらに、この結果によって、MHC-Iシグナルを認識受容したAltRは、正常細胞の攻撃能を促進する性質を有することを解き明かすことができた。
*3 RasV12タンパク質
原がん遺伝子Rasの12番目のグリシン(G)がバリン(V)に変異することで、がん遺伝子RASV12となる。このがん遺伝子RASV12にコードされるタンパク質がRasV12である。このがんタンパク質RasV12はタンパク質Rasの恒常活性型であり、上皮細胞においては細胞極性崩壊や細胞増殖を促進させるなどにより、細胞のがん化促進の原因となる。
*4 in vitroの細胞競合モデル
正常な培養細胞 (イヌ腎臓上皮細胞MDCK細胞やヒト皮膚上皮細胞HaCaT細胞)とRasV12を発現する前がん細胞を共培養することで、細胞競合現象をin vitro(培養ディッシュ上)で再構築したシステムのこと。正常細胞と前がん細胞を混合し単層を形成させたあとに前がん細胞のRasV12の発現を誘導することで、上皮細胞層中に前がん細胞が生じた段階を模倣している。細胞層中の前がん細胞は、正常細胞に押し出されて最終的に上皮細胞層の頂端側に排除される。
*5 リコンビナント(rec.MHC-I α3もしくはrec.AltR D1/2)
正常細胞のAltRとの相互作用部位であるMHC-Iの細胞外ドメインであるα3ドメイン、またαドメインの結合するAltRのD1/2ドメインをそれぞれリコンビナントタンパク質rec.MHC-I α3とrec.AltR D1/2として人工的に精製した。Rec.MHC-I α3は、正常細胞のAltRと相互作用することで、正常細胞の攻撃機能を促進する。一方で、rec.AltR D1/2はMHC-IとAltRの相互作用を競合的に阻害することで、正常細胞の攻撃機能の惹起を阻害する。
*6 in vivoマウスモデル
マウスに腫瘍形成や発がんさせる実験系であり、これにより腫瘍形成過程の観察や発がんへの関与を解析できる。腫瘍形成に関しては、マウスに正常HaCaT細胞と前がん細胞を混合し皮下移植することで、マウスの皮下における腫瘍形成過程を観察できる。発がんに関しては、マウスにウレタンを投与すると肺において原がん遺伝子Rasにがん変異が生じ、発がんが誘導される。発がんの初期段階では肺に悪性結節*7が形成される。
*7 悪性結節
肺において細胞が異常に増殖した結果、細胞濃度が高くなっている病変部位が結節である。がんの前病変である悪性結節では、発がんの初期段階に観察される。ウレタンを用いたin vivoマウスモデルでは、悪性結節中の細胞において原がん遺伝子Rasにがん変異が生じている。
(5)論文情報
雑誌名:Nature Immunology
論文名:Epithelial cells remove precancerous cells by cell competition via class I MHC-LILRB3 interaction
執筆者名(所属機関名):鮎川志優1, 鴨下渚2†, 中山淳1†, 寺本龍平1, Novalia Pishesha3, 大庭賢二a4, 佐藤奈波5, 小澤慶5, 安部光1, 仙波憲太郎1, 合田亘人1, 藤田恭之5,6, 丸山剛2,*
(1 早稲田大学大学院先進理工学研究科生命医科学専攻, 2 早稲田大学高等研究所, 3 ハーバード大学, 4 自治医科大学分子病態治療研究センター遺伝子治療研究部, 5 北海道大学遺伝子病制御研究所分子腫瘍分野, 6 京都大学医学部分子腫瘍学, † These authors are equally contributed, * 責任著者)
(6)研究助成
- 研究費名:AMED prime
研究課題名:時空間的異常センシングによるがん変異細胞除去修復
研究代表者名(所属機関名):丸山 剛(早稲田大学)
- 研究費名:JSTさきがけ
研究課題名:光操作型-生体内不均一変異細胞誘導と変異細胞の挙動解明
研究代表者名(所属機関名):丸山 剛(早稲田大学)
3.藤田智弘講師の研究活動紹介
2021年秋より、宇宙論の最先端の研究について議論する場の提供を目的としたセミナーシリーズが立ち上がりました。セミナーの趣旨とこれまでの講演内容について、企画者の藤田智弘講師より報告します。
2021年9月からWIAS主催のセミナーシリーズ 「宇宙論研究の最前線 – Tokyo New Faces in Cosmology – 」を開始しました。新型コロナウイルスの影響で研究者同士の情報交換や共同研究が阻害される一方で、これまで海外において第一線で活躍してきた研究者が続々と国内に戻って来てきています。当セミナーシリーズでは東京近郊の研究機関に所属する帰国組の研究者を早稲田大学にお招きし、ハイブリット形式のセミナーをして頂いております。オンライン配信によってセミナー講師の方が日本国内へ最先端の研究を紹介すると同時に、現地での顔を合わせた議論によって新しい研究を創発する契機にしてもらうのが当セミナーシリーズの趣旨です。これまで月一回の頻度で、第1回(9/22), 第2回(10/22)、第3回(11/25)、第4回(12/21)と年内に計4回開催してきました。以下、これまでのセミナーの概要をお伝えします。
第1回は理化学研究所上級研究員の難波亮先生に講演「宇宙論における低エネルギー有効理論への還元と、UV理論との整合条件について」をしていただきました。ある種の宇宙理論の仮説ではCausticと呼ばれる動的特異点が現れ、その特異点近傍では有効理論が破綻するため、Causticを持つような理論は棄却される、ないし高エネルギーではより精密な理論に置き換えられることが予想されます。Causticは必ずしも新しい概念ではありませんが、国内での研究は進んでおらず、日本語の定訳も知られていません。講演の後半ではPositivity bound等の最新の理論的発展とCausticの関係についても触れられ、素粒子論の文脈から見るとCausticはどのように捉えられるかなど、新しい研究につながるような議論もいくつも出て非常に有意義なセミナーとなりました。第1回の開催時ではまだ新型コロナウイルス緊急事態宣言下で現地参加者を受け入れられませんでした。それでも、Zoomを用いたオンライン参加者から積極的な発言があり、活発な議論がかわされたことは、このようなセミナーに対する幅広いニーズがあると感じさせてくれました。
第2回は東京大学Kavli IPMU教授の佐々木節先生に講演「原始ブラックホール宇宙論」をしていただききました。原始ブラックホールとは宇宙初期に形成されるブラックホールで、1kg程度の極めて軽いものも存在するかもしれません。近年は暗黒物質の候補として、あるいは重力波を通じて観測されているブラックホール連星の起源として、非常に注目が集まっています。原始ブラックホールが暗黒物質の正体だと仮定すると、宇宙重力波望遠鏡LISAによって原始ブラックホールの生成に伴って放出された重力波をほぼ確実に捉えることができる、という成果も紹介してもらいました。オンラインでは著名な研究者も含めた100名もの参加者が集まり、このテーマの注目度の高さが伺えました。さらに第2回からは緊急事態宣言が解除されたことで、人数制限はあるものの現地参加者を受け入れ、宇宙論を学んでいる早稲田の学部4年生から名古屋大学の専門家まで様々な方が現地に来て下さり、活発な質疑応答が交わされました。
第3回は高エネルギー加速器研究機構助教の向田享平先生に講演「カイラル量子異常とインフレーション」をしていただきました。素粒子理論では物質と反物質は対称的であるにも関わらず、我々の住む宇宙はほぼ物質のみで満たされています。この非対称性の起源として、カイラル量子異常が注目されています。CP対称性を破るようなAxion-likeインフラトンがあり、物質と結合している場合には、量子異常を通じてバリオン数生成が起きると期待されます。しかし、カイラル量子異常の方程式を満たすように、ゲージ場と荷電粒子の両者が生成されるプロセスは完全に理解されてはおらず、そのメカニズムへの洞察が最終的なシナリオ全貌の解明に不可欠であることを説明していただきました。この過程では強い重力波も放出されると期待されるため、今後理解が進めば将来観測される重力波を具体的に予言することも可能となるでしょう。
第4回は理化学研究所基礎科学特別研究員の大下翔誉先生に講演「ブラックホール振動の和音とその重要性」をしていただきました。近年、ブラックホール連星系合体イベントから放射される重力波の観測が進むのに伴って、合体後のブラックホールの変形モードであるquasi-normal modeに注目が集まっており、大下先生はその高次倍音成分を研究されています。大下先生にはブラックホールの変形のしやすさを理論的に計算する方法、それらと数値シミュレーションを組み合わせてブラックホールの物理を探求する方法を解説して下さいました。将来、重力波観測の精度が高まっていけば、高次モードの情報からブラックホールの構造などを詳しく調べられるようになるかもしれません。ブラックホールは古くから研究されてきた古典的問題ではありますが、まだまだ研究分野の伸びしろを感じさせるセミナーでした。
上記のように宇宙論の関連分野の中から様々なテーマを講演していただき、オンラインと現地参加者の双方が入り混じって、活発に意見を交換できる機会になっております。今後とも本セミナーシリーズを続け、東京近郊および日本における宇宙論研究を盛り立てていきたいと考えております。

4.新研究プロジェクト「人新世と人文学」紹介
当研究所の新たな研究プロジェクト「人新世と人文学」が、2021年10月より開始しました。人新世(Anthropocene)とは、2000 年 2月の IGBP(International Geosphere-Biosphere Programme)科学委員会会議において、大気化学者でありノーベル化学賞を受賞したパウル・クルッツェン(Paul Crutzen)により提唱された、現代を含む新しい地質学的時代区分です。人類が地球環境に大きな影響を与えることで、約 11,700 年前に始まった完新世(Holocene)が終焉し、私たちは既に人新世に生きているとする問題提起で、自然科学領域だけでなく、社会科学そして人文科学における議論へも展開しています。
本プロジェクトは、当研究所副所長である山本聡美教授を中心に、当研究所の若手研究者および名古屋大学、ハーバード大学から、美術史、文学、哲学、美学、音楽、建築学、考古学、認知神経学、環境経済学、環境農学と多岐にわたる専門分野の研究者が参画する領域横断型の研究組織となっており、プロジェクトの活動を通じて人新世の概念を共有し、その射程についての議論を重ねることで、互いの専門知を融合した共同研究の場を開拓することを第一の目的としています。その上で、人文科学において蓄積されてきた「人類の営み」に関する古典知を、現在と未来の社会における課題に接続し活用・発信する方法の確立を目指します。
プロジェクトのキックオフイベントとして、2021年12月4日(土)に、第1回となる公開セミナーを開催しました。はじめに主催者である山本副所長より趣旨説明が、プロジェクトメンバーであるハーバード大学教授のユキオ・リピット教授より人新世やエコクリティシズム、そして環境美術史に関する米国の研究動向や今後の可能性に関するスピーチがあり、その後、岐阜大学応用生物科学部の大西健夫准教授より「地球史における水・土・人の循環」をテーマに講演いただきました。講演では、水・土・人が織りなす循環のダイナミズムに基づく環境の変化は一般に人新世の始まりとされる産業革命(18世紀)よりもはるかに前から起こっているという観点から、人新世に関わる最近の研究動向について紹介があり、地球システムが非常に複雑であることをようやく人類は理解し始めたが、皮肉にも人類が作った現代社会システムはそれを模倣しきれず、地球温暖化などを引き起こしているのではないかとの問題提起がなされました。身近な事象をとりあげて複雑系科学や非線形力学について説明する等の工夫がされた講演は大変理解しやすく刺激的で、参加者とのディスカッションでは、縄文人の生活様式、人間の行動を加味したシミュレーションの必要性、科学的な知見と文献資料を組み合わせた歴史の再解釈研究の動向、歴史を線形のものとしてとらえる従来の研究のあり方等、さまざまなトピックについて活発な意見交換がされました。
本研究プロジェクトでは、引き続き人新世にかかわる公開セミナー・研究会を開催しながら、多様な専門分野の研究者が協働できる場の形成を進めてまいります。
ご意見、ご感想をお待ちしています。 下記発行元までお寄せください。
早稲田大学高等研究所
〒169-0051
東京都新宿区西早稲田1-21-1 早稲田大学西早稲田ビル1階
URL:www.waseda.jp/inst/wias/
TEL:03-5286-2460
FAX:03-5286-2470
E-mail:[email protected]








