
理工学術院 教授 仙波 憲太郎(せんば・けんたろう)
東京大学薬学部卒業、同大学院薬学系研究科博士課程中退(助手採用のため)。博士(薬学)。専門は有機合成化学・生物活性天然物の全合成。1997年度日本薬学会奨励賞、2008年度(第1回)有機合成化学協会アステラス製薬・生命有機化学賞受賞。
がんの増殖は、特定のがん遺伝子の働きに依存している。この弱点を狙い撃ちする分子標的薬が、がん治療で注目されている。
遺伝子変異の蓄積によるがんの出現
2人に1人ががんにかかるといわれて久しい。平均寿命が延び、医療費の増大が大きな社会問題になっている中、個人や国家の医療費負担を減らすために、がんの早期発見と効果的な治療法の開発は急務である。分子生物学の発展に伴い、特定のタイプの乳がんや肺がんなどに対して、がん細胞の増殖に関わるタンパク質を狙い撃ちする薬(分子標的薬)が開発され、大きな効果をもたらしている。
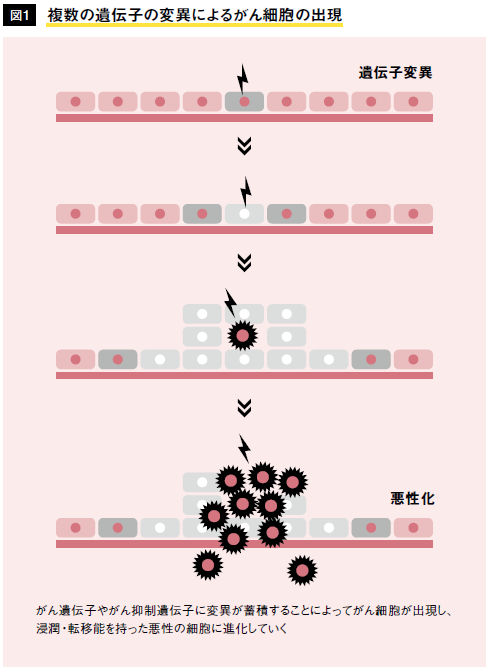
はじめに、がんができる仕組みと分子標的薬について簡単に紹介したい。われわれは30億の塩基対からなるDNA の中に、ヒトであるために必要な全ての遺伝情報(ゲノム)を遺伝子の形で格納している。遺伝情報は塩基の並び方によって書き込まれているが、発がん剤による化学反応や放射線などによって塩基に変異や切断が入ると、異なる遺伝情報に書き変えられる。こうした変異は日々体中の細胞で起こっているが、変異が蓄積すると、まれに周りの組織と調和せずに勝手に増え始める細胞が出現する。これががん細胞である。がん細胞がある種の遺伝子がん原遺伝子)の変異によって生じることは予想されたが、実際にわれわれが変異がん原遺伝子(がん遺伝子)を手にしたのは、今からわずか30年ほど前である。がんの研究者たちはがん遺伝子の発見にたいへん興奮した。なぜなら、がん細胞から見つかった最初のがん遺伝子(変異RAS 遺伝子)は、正常な細胞が持つRAS 遺伝子と比べて、たった一つの塩基の変異しか持っていなかったのである。しかも、その変異はRAS タンパク質を常に活性化した状態に留め置き、細胞に増殖信号を送り続けていた。

がん遺伝子の導入によって人工的に作られたがん細胞
今では、われわれのゲノムの中には、変異によってがんをつくる方向に働く「がん原遺伝子」と、がんができないように抑える「がん抑制遺伝子」が存在することが分かっている。われわれのゲノムの中にがん原遺伝子があるというのは非常に不自然なことに思われる。しかし進化をたどってみると、実はがん原遺伝子はショウジョウバエのような下等な生物から保存されていたことが分かる。生物進化の間、細胞の増殖を調節するという非常に重要な役目を担ってきたのである。皮肉なことに、いったん変異が生じてがん遺伝子に変化すると、増殖を調節する機能が破壊されて、制御が利かなくなってしまう。とはいえ、一般的にヒトのがんは、たった1個のがん原遺伝子が変異するだけでできるものではない。数十年かけて、複数のがん原遺伝子やがん抑制遺伝子の変異が蓄積することによって、高い増殖能と転移能を持つ悪性のがんに「進化」していくと考えられている(図1)。そう簡単には、ヒトはがんにならないというわけである。
正確な診断と適切な治療を実現するために
前述のように、がんは複数の遺伝子の変異が蓄積していくことで、周囲の組織との協調性を失い、浸潤・転移する能力を持った、たちの悪いものに「進化」する。目に見えないところで進むこうした進化の間も、がんは特定のがん遺伝子の働きに頼って増殖しているのである。言い換えると、このような遺伝子はがんにとっての弱み、いわば「がんのアキレス腱」となり得る。アキレス腱をピンポイントで狙う薬が開発できないだろうか―。こうした研究者たちの取り組みは、やがて「分子標的薬」として結実することになる。
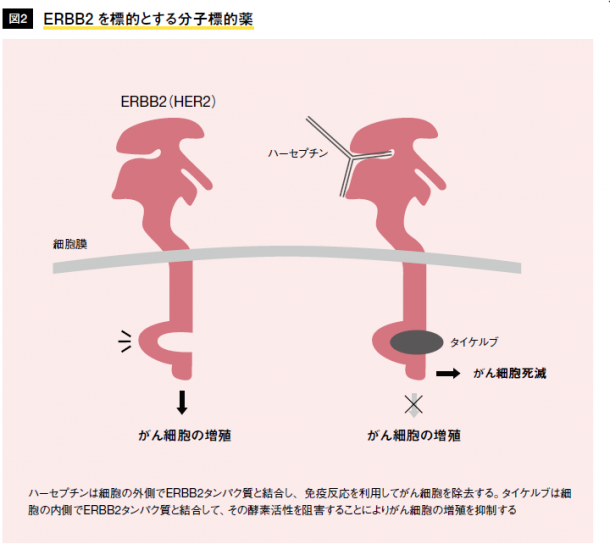
一例として、ERBB2(HER2)遺伝子を挙げよう。ERBB 2遺伝子は、25%の乳がんで遺伝子増幅(遺伝子の数が数十倍に増える現象)によって過剰に発現していて、がん遺伝子として働く(注1)。ハーセプチンと呼ばれる分子標的薬は、ERBB2タンパク質に対する抗体である。また、タイケルブは、ERBB2タンパク質の酵素活性を阻害する低分子化合物である(図2)。ERBB2遺伝子が過剰に発現する乳がんでは、これらの薬が有効な治療薬となる。しかし、残念ながらERBB2遺伝子が発現していないがんでは、これらの分子標的薬はまったく効果がない。したがって、これからの課題は、がんの分類とそれぞれのタイプのがんでアキレス腱となる遺伝子を見つけることであり、今なお、その探索は続けられている。
注1 正確には、乳がんで過剰発現するERBB2遺伝子はRAS遺伝子と違って変異を持たない。量の変化によってもがん原遺伝子ががん遺伝子として働くのである
参考文献:Saito M et al, FEBS Lett. 586, 1708-1714, 2012/Doi A et al, Mol Oncol, 10.1016/j.molonc.2014.09.005
私たちの研究室では、シャーレの中で培養した特殊な細胞を用いて、いくつかのがん原遺伝子を見つけている。中には一人前のがん原遺伝子とはいえないものもある。GRB 7遺伝子は、単独の過剰発現では細胞をがん化させることはできないが、ERBB 2 遺伝子のがん化活性を促進する。面白いことに、ERBB2遺伝子とGRB7遺伝子はゲノム上近い距離にあって、同時に遺伝子増幅していることが多い。乳がんで見られる2つの遺伝子の同時過剰発現は、ERBB2遺伝子によるがん化を促進する可能性を秘めている(斉藤ら、2012)。また、ビタミンA の受容体として知られる遺伝子が、がん細胞の浸潤を促進するという新たな成果も得られた(土井ら、2014)。
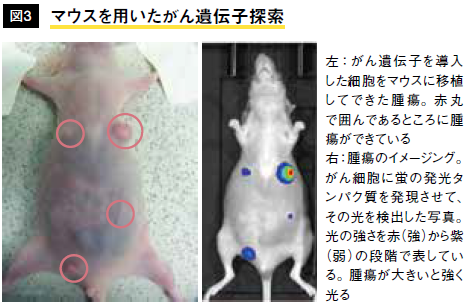 シャーレを用いた遺伝子探索は、確かに新たながん原遺伝子の発見につながったが、「はたして生体内の環境で、同じような作用を起こすのだろうか。また、生体内でのみ働くものもあるのではないか」。私たちはその疑問に答えるために、マウスを用いたがん原遺伝子探索を行った(図3)。その結果、新たに4種類の遺伝子が過剰発現により、がん遺伝子として働くことを見いだした。興味深いことに、これらのうち3種類は、30年ほど前の研究で見つかっていた遺伝子と互いによく似た構造のタンパク質を指令することが分かった(伊原、細川ら、未発表)。これらのがん原遺伝子はシャーレを用いた従来の探索では見つかってこなかったものである。おそらくは、生体内でがん細胞を取り巻くホルモンなどの因子が大きく影響するのだろう。どのようにがんができるのかという仕組みには、興味が尽きない。はたして見つけた遺伝子ががんの診断に役立つのか、治療の標的となり得るのかという問いに、一日も早く答えたいと願いながら、日々の研究に勤しんでいる。
シャーレを用いた遺伝子探索は、確かに新たながん原遺伝子の発見につながったが、「はたして生体内の環境で、同じような作用を起こすのだろうか。また、生体内でのみ働くものもあるのではないか」。私たちはその疑問に答えるために、マウスを用いたがん原遺伝子探索を行った(図3)。その結果、新たに4種類の遺伝子が過剰発現により、がん遺伝子として働くことを見いだした。興味深いことに、これらのうち3種類は、30年ほど前の研究で見つかっていた遺伝子と互いによく似た構造のタンパク質を指令することが分かった(伊原、細川ら、未発表)。これらのがん原遺伝子はシャーレを用いた従来の探索では見つかってこなかったものである。おそらくは、生体内でがん細胞を取り巻くホルモンなどの因子が大きく影響するのだろう。どのようにがんができるのかという仕組みには、興味が尽きない。はたして見つけた遺伝子ががんの診断に役立つのか、治療の標的となり得るのかという問いに、一日も早く答えたいと願いながら、日々の研究に勤しんでいる。
(『新鐘』No.81掲載記事より)
※記事の内容、教員の職位などは取材当時のものです。








