脳の発生に重要な新しい因子を発見
SUMO化によるミトコンドリア形態制御を介した脳発生調節機構を明らかに
発表のポイント
脱SUMO化酵素Senp5の新規アイソフォーム(Senp5S)を発見し、Senp5Sが他の脱SUMO化酵素群と拮抗することでSUMO化を促進することを明らかにした。
SUMO化と脱SUMO化のバランスによりミトコンドリアの形態が制御されることを明らかにした。
SUMO化と脱SUMO化のバランスが正常な脳の発生に重要であることを明らかにした。
早稲田大学人間科学学術院の榊原伸一(さかきばらしんいち)教授と山田晴也(やまだせいや)助手らの研究グループは、タンパク質の翻訳後修飾(※1)の1つであるSUMO化(※2)による新しい脳発生の調節機構をこのたび明らかにしました。SUMO化を調節する重要な因子として、SUMOを標的タンパク質から切り離す働きを持つ脱SUMO化酵素群Senps (Senp1-8)が知られています。SUMO化と脱SUMO化の調節サイクルはアルツハイマー病やパーキンソン病などの神経疾患、がん、心臓病など様々な疾患に関与し、我々が生きる上で重要な生命現象です。しかし、その制御機構には未解明な点が多く、脳の発達に与える影響に関しても不明でした。
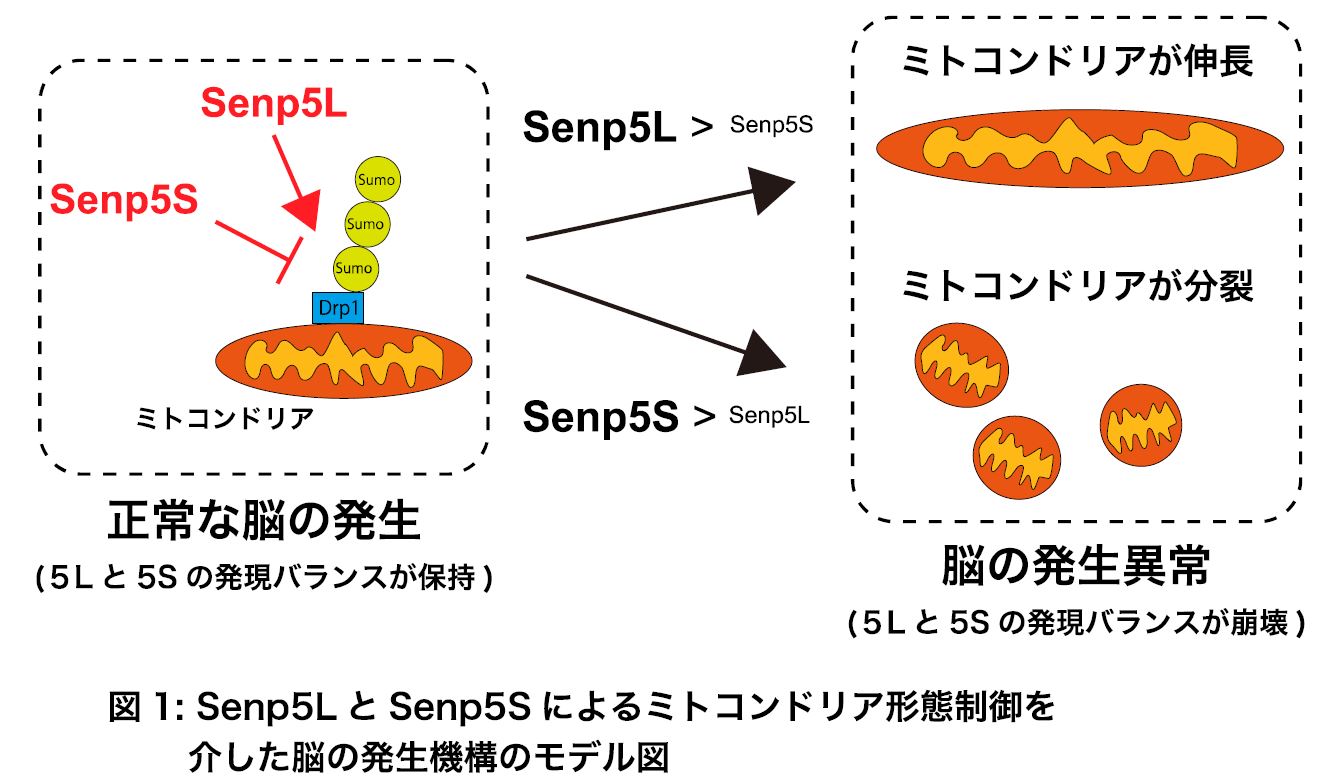
本研究グループはSenp5に着目し、これまで未報告であったSenp5の新しいアイソフォーム(Senp5S)を発見しました。そして、このSenp5Sと従来型のSenp5 (Senp5L)がSUMO化と脱SUMO化のバランスを調節することで細胞内のミトコンドリアの形態を制御し、正常な脳の発生を調節することを明らかにしました(図1)。本研究で明らかにされたSUMO化によるミトコンドリア形態制御機構が、様々な疾患発症原因の解明に寄与できると期待されます。
本研究成果は、米国のオープンアクセスジャーナル『iScience』のオンライン版に2021年12月10日(金)(米国東部標準時)に掲載されました。
(1) これまでの研究で分かっていたこと(科学史的・歴史的な背景など)
ミトコンドリアは融合と分裂を行うことで形態変化し、それらの破綻は脳の形態異常を含む様々な発達異常を引き起こすことが知られています。ミトコンドリアの分裂はDrp1タンパク質により制御されることが多数の研究から明らかになっています。しかし、Drp1が翻訳後修飾の1つであるSUMO化修飾を受けることは報告されていたものの、詳細な分子機構に関しては不明な点が多くありました。また、SUMO化がどのように脳の発達に影響を与えるかに関しても明らかになっていませんでした。
(2) 今回の研究で新たに実現しようとしたこと、明らかになったこと
本研究では、SUMO化及び、脱SUMO化酵素Senp5に着目しました。そして、マウス脳から酵素活性の無いSenp5の新しいアイソフォーム(Senp5S)を発見しました(図2)。また、培養細胞とマウス胎仔を用いた実験を行い、「Senp5Sと従来のSenp5(Senp5L)がSUMO化と脱SUMO化のバランスを調節することで、ミトコンドリアの形態制御を介して脳発生を司る」という仮説を検証しました。
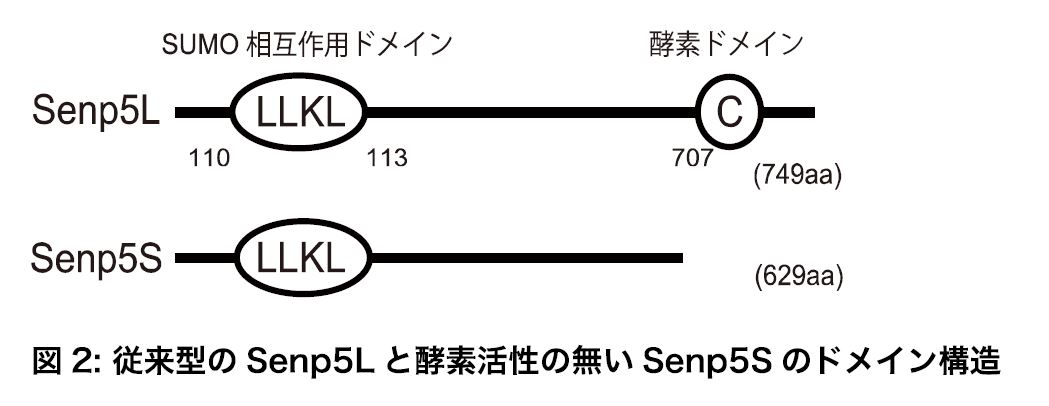
本研究で新規同定したSenp5Sは酵素活性領域が欠失していたため(図2)、脱SUMO化能が無いと予想されました。検証の結果、Senp5Sを過剰発現させると脱SUMO化できないだけでなく、他のSenpsと拮抗することでSUMO化を促進することが明らかになりました(図1)。
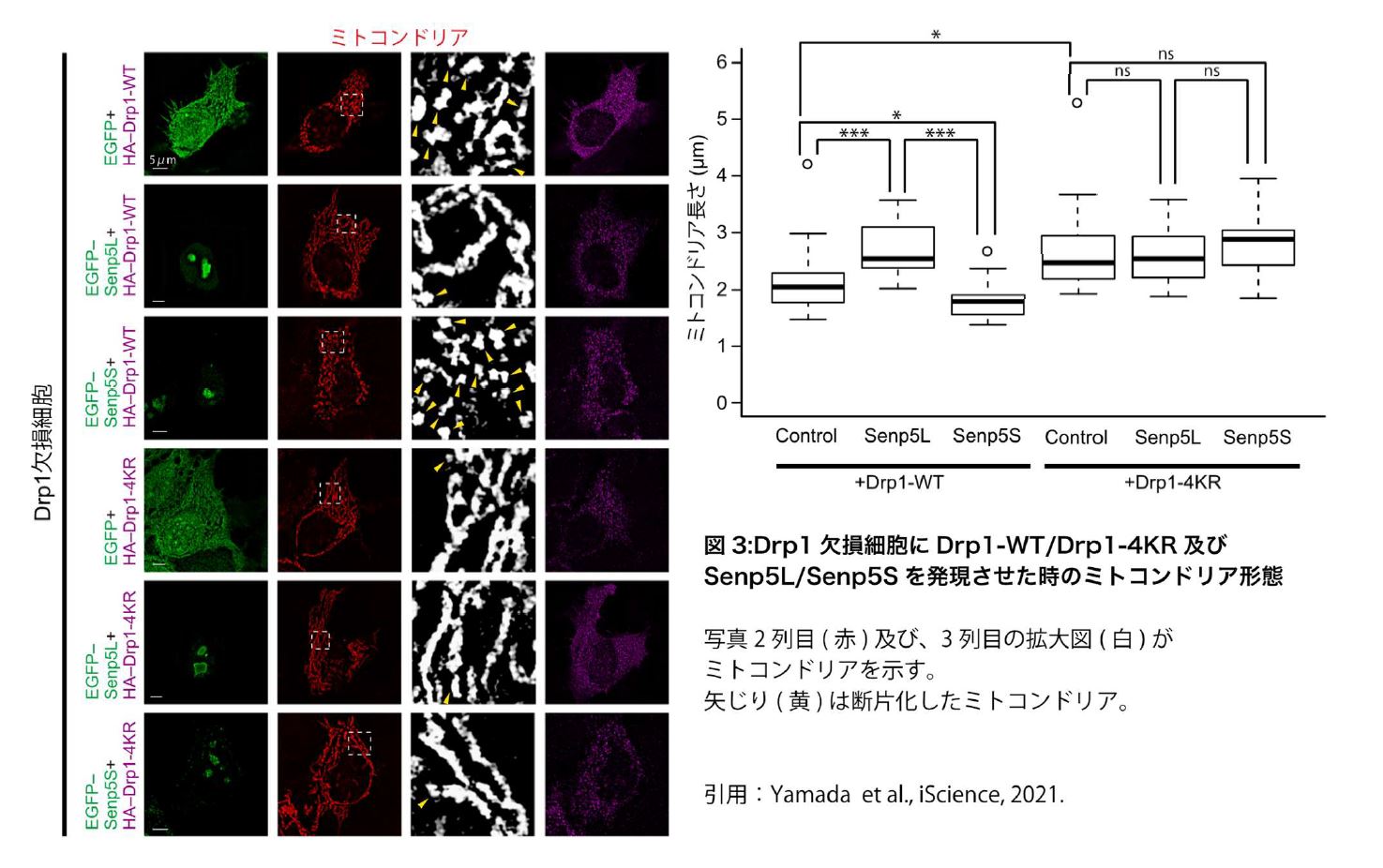
次に、Senp5SとSenp5LがDrp1のSUMO/脱SUMO化バランスを調節することでミトコンドリア形態を制御するかを、Drp1欠損細胞とDrp1のSUMO化変異体(Drp1-4KR)(※3)を用いて検証しました。その結果、Senp5SによるDrp1のSUMO化促進条件ではミトコンドリアの分裂が促進し、Senp5LやDrp1-4KRなどDrp1のSUMO化抑制条件では分裂が抑制されることが明らかになりました(図3)。
続けて、Drp1のSUMO化によるミトコンドリア形態制御の詳細なメカニズムを明らかにするため①小胞体、②ユビキチン化(※4)に着目しました。
- 近年の研究でDrp1が小胞体にも局在し、小胞体の形態調節を介してミトコンドリアの分裂を行うことが明らかにされています。そこでDrp1-4KRを用いて、小胞体の形態変化を検討した結果、Drp1-4KRの発現時では小胞体の網目構造が破綻し、シート状になることが分かりました。
- SUMO化がDrp1の安定性に関与する可能性を検討しました。その結果、Drp1の脱SUMO化時、ユビキチン化の促進が認められ、Drp1の安定性に関与する可能性が示唆されました。これらの結果より、Drp1のSUMO化制御が小胞体の形態変化とユビキチン化の双方に関与することでミトコンドリアの形態を制御する可能性が示唆されました。
最後に脳発生時のSUMO化の役割を調べるため、マウス胎仔脳内でSenp5の発現抑制と強制発現を行いました。その結果、双方の場合で神経細胞の移動の障害を伴う大脳皮質の発生異常が認められました。
以上の結果より、Senp5SとSenp5LがDrp1のSUMO/脱SUMO化のバランスを調節することでミトコンドリアの形態を制御し、正常な大脳皮質の発生を調節することが明らかになりました。
(3) 研究の波及効果や社会的影響
近年の研究からSUMO化やミトコンドリアの形態調節が、脳の形態異常を含む発達異常やアルツハイマー病、パーキンソン病などの神経疾患、がん、心臓病など様々な疾患に関与することが分かってきています。本研究により新規同定されたSenp5Sが、発達異常に関わる疾患発症の原因解明やSUMO化をターゲットとする創薬開発へつながることが期待されます。
(4) 今後の課題
今回、大脳皮質発生時におけるSenp5の役割が明らかになりましたが、成体の脳や他の組織における役割、また、Senp5の他の標的タンパク質、疾患との関連には不明な点を多く残しています。これらの謎を解き明かしていくことが、今後の研究課題になると考えられます。
(5) 用語解説
※1: 翻訳後修飾
タンパク質が翻訳された後に、タンパク質へ付加される修飾のこと。SUMO化、ユビキチン化、リン酸化、糖鎖修飾などがあり、生体内において、タンパク質の機能発現や活性調節、安定化などに関わる。
※2: SUMO化
SUMOはSmall Ubiquitin-related Modifierの略で、ユビキチンと構造が良く似た約100アミノ酸残基からなる低分子量タンパク質。ヒトにはSUMO1-4が存在する。SUMO化は翻訳後修飾の1つで、SUMO分子が標的タンパク質に共有結合することにより、各標的タンパク質の活性調節や安定化、局在変化など様々な細胞内分子機構を調節する。標的タンパク質からSUMOを解離する脱SUMO化はSenps (Senp1-8)が担う。
※3: SUMO化変異体
標的タンパク質のSUMO化結合部位のK(リジン)をアミノ酸置換することでSUMO化できなくさせた変異体。本研究では、Drp1のアミノ酸配列の中で4つのK(リジン)をR(アルギニン)に置換したSUMO化変異体(Drp1-4KR)を用いた。
※4: ユビキチン化
翻訳後修飾の1つ。標的タンパク質がユビキチンの修飾を受けた場合、プロテアソームによって認識されタンパク質の分解を受ける。
(6) 論文情報
雑誌名:iScience
論文名:Drp1 SUMO/deSUMOylation by Senp5 isoforms influences ER tubulation and mitochondrial dynamics to regulate brain development
執筆者名(所属機関名):Seiya Yamada(山田晴也)1, Ayaka Sato(佐藤彩佳)1, Naotada Ishihara(石原直忠)2, Hiroki Akiyama(秋山博紀)1,3*, and Shin-ichi Sakakibara(榊原伸一)1*
1) 早稲田大学 人間科学学術院 分子神経科学研究室
2) 大阪大学 理学研究科 生物科学専攻 細胞生命科学研究室
3) 早稲田大学 人間科学学術院 人間総合研究センター
*) 責任著者
掲載日(現地時間): 2021年12月10日(金)(米国東部標準時)
掲載URL: https://www.cell.com/iscience/fulltext/S2589-0042(21)01455-3
DOI: https://doi.org/10.1016/j.isci.2021.103484
(7) 研究助成
研究費名:基盤研究(C)
研究課題名:新規SUMO化調節機構による神経突起発達制御
研究代表者名(所属機関名):秋山博紀 (早稲田大学)
研究費名:基盤研究(C)
研究課題名:神経前駆細胞の形態・移動を制御する新規分子群の機能解明
研究代表者名(所属機関名):榊原伸一 (早稲田大学)
(8)研究者のコメント
本研究は早稲田大学の研究グループ(山田氏、佐藤氏、秋山先生)と大阪大学の石原先生、皆様の協力により論文化できました。SUMO化は多数の疾患にも関与する重要な生命現象です。本研究は、SUMO化の新たな調節機構を発見したこと、またSUMO化とミトコンドリア形態制御、脳発生を結びつける知見を得たことから、今後の基礎研究への影響のみならず臨床的な観点からも社会的な意義は大きいと考えています。